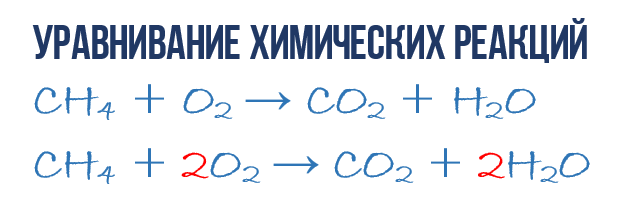Как решать задачи С1 (30) на ЕГЭ по химии. Часть III
Продолжаем обсуждать решение задачи вида С1 (№ 30), которая обязательно встретится всем, кто будет сдавать ЕГЭ по химии. В первой части статьи мы изложили общий алгоритм решения задачи 30, во второй части разобрали несколько достаточно сложных примеров.
Третью часть начнем с обсуждения типичных окислителей и восстановителей и их превращений в различных средах.
Пятый шаг : обсуждаем типичные ОВР, которые могут встретиться в задаче №30
Хотелось бы напомнить несколько моментов, связанных с понятием степени окисления. Мы уже отмечали, что постоянная степень окисления характерна лишь для относительно небольшого числа элементов (фтора, кислорода, щелочных и щелочноземельных металлов и т. п.) Большинство элементов может проявлять разные степени окисления. Например, для хлора возможны все состояния от -1 до +7, хотя наиболее стабильны нечетные значения. Азот проявляет степени окисления от -3 до +5 и т. д.
Следует четко запомнить два важных правила.
1. Высшая степень окисления элемента — неметалла в большинстве случаев совпадает с номером группы, в которой находится данный элемент, а низшая степень окисления = номер группы — 8.
Например, хлор находится в VII группе, следовательно, его высшая степень окисления = +7, а низшая — 7 — 8 = -1. Селен находится в VI группе. Высшая степень окисления = +6, низшая — (-2). Кремний расположен в IV группе; соответствующие значения равны +4 и -4.
Запомните, что из этого правила есть исключения: высшая степень окисления кислорода = +2 (и даже она проявляется только во фториде кислорода), а высшая степень окисления фтора = 0 (в простом веществе)!
2. Металлы не способны проявлять отрицательные степени окисления. Это довольно важно, учитывая, что более 70% химических элементов относятся именно к металлам.
А теперь вопрос: «Может ли Mn(+7) выступать в химических реакциях в роли восстановителя?» Не спешите, попробуйте ответить самостоятельно.
Правильный ответ: «Нет, не может!» Объяснить это очень легко. Взгляните на положение этого элемента в периодической системе. Mn находится в VII группе, следовательно, его ВЫСШАЯ степень окисления равна +7. Если бы Mn(+7) выступал в роли восстановителя, его степень окисления повысилась бы (вспомните определение восстановителя!), а это невозможно, поскольку она и так имеет максимальное значение. Вывод: Mn(+7) может быть только окислителем.
По той же причине ТОЛЬКО ОКИСЛИТЕЛЬНЫЕ свойства могут проявлять S(+6), N(+5), Cr(+6), V(+5), Pb(+4) и т. д. Взгляните на положение этих элементов в периодической системе и убедитесь в этом сами.
И еще вопрос: «Может ли Se(-2) выступать в химических реакциях в роли окислителя?»
И вновь отрицательный ответ. Вы, вероятно, уже догадались, в чем тут дело. Селен находится в VI группе, его НИЗШАЯ степень окисления равна -2. Se(-2) не может ПРИОБРЕТАТЬ электроны, т. е., не может быть окислителем. Если Se(-2) участвует в ОВР, то только в роли ВОССТАНОВИТЕЛЯ.
По аналогичной причине ТОЛЬКО ВОССТАНОВИТЕЛЕМ может быть N(-3), P(-3), S(-2), Te(-2), I(-1), Br(-1) и т. д.
«А что, если элемент имеет промежуточную степень окисления?» — спросите вы. Ну, тогда возможно и его окисление, и его восстановление. Например, сера в реакции с кислородом окисляется, а в реакции с натрием — восстанавливается.
Наверное, логично предположить, что каждый элемент в высшей степени окисления будет выраженным окислителем, а в низшей — сильным восстановителем. В большинстве случаев это действительно так. Например, все соединения Mn(+7), Cr(+6), N(+5) можно отнести к сильным окислителям. Но, например, P(+5) и С(+4) восстанавливаются с трудом. А уж заставить Ca(+2) или Na(+1) выступить в роли окислителя практически невозможно, хотя, формально говоря, +2 и +1 — это тоже высшие степени окисления.
Наоборот, многие соединения хлора (+1) являются мощными окислителями, хотя степень окисления +1 в данном случае далека от высшей.
F(-1) и Cl(-1) — плохие восстано­вители, а их аналоги (Br(-1) и I(-1)) — хорошие. Кислород в низшей степени окисления (-2) практически не проявляет восстановительные свойства, а Te(-2) — мощный восстановитель.
Мы видим, что все не так очевидно, как хотелось бы. В ряде случаев, способность к окислению — восстановлению можно легко предвидеть, в других случаях — нужно просто запомнить, что вещество Х — это, скажем, хороший окислитель.
Кажется, мы наконец-то добрались до списка типичных окислителей и восстановителей. Хотелось бы, чтобы вы не просто «вызубрили» эти формулы (хотя и это будет неплохо!), но и смогли бы объяснить, почему то или иное вещество попало в соответствующий список.
Типичные окислители
- Простые вещества — неметаллы: F 2 , O 2 , O 3 , Cl 2 , Br 2 .
- Концентрированная серная кислота (H 2 SO 4 ), азотная кислота (HNO 3 ) в любой концентрации, хлорноватистая кислота (HClO), хлорная кислота (HClO 4 ).
- Перманганат калия и манганат калия (KMnO 4 и K 2 MnO 4 ), хроматы и бихроматы (K 2 CrO 4 и K 2 Cr 2 O 7 ), висмутаты (напр., NaBiO 3 ).
- Оксиды хрома (VI), висмута (V), свинца (IV), марганца (IV).
- Гипохлориты (NaClO), хлораты (NaClO 3 ) и перхлораты (NaClO 4 ); нитраты (KNO 3 ).
- Пероксиды, надпероксиды, озониды, органические перекиси, пероксокислоты, все остальные вещества, содержащие группировку -O-O- (напр., пероксид водорода — H 2 O 2 , пероксид натрия — Na 2 O 2 , надпероксид калия — KO 2 ).
- Ионы металлов, расположенных в правой части ряда напряжений: Au 3+ , Ag + .
Типичные восстановители
- Простые вещества — металлы: щелочные и щелочноземельные, Mg, Al, Zn, Sn.
- Простые вещества — неметаллы: H 2 , C.
- Гидриды металлов: LiH, CaH 2 , алюмогидрид лития (LiAlH 4 ), боргидрид натрия (NaBH 4 ).
- Гидриды некоторых неметаллов: HI, HBr, H 2 S, H 2 Se, H 2 Te, PH 3 , силаны и бораны.
- Иодиды, бромиды, сульфиды, селениды, фосфиды, нитриды, карбиды, нитриты, гипофосфиты, сульфиты.
- Угарный газ (CO).
Хотелось бы подчеркнуть несколько моментов:
- Я не ставил перед собой цели перечислить все окислители и восстановители. Это невозможно, да и не нужно.
- Одно и то же вещество может выступать в одном процессе в роли окислителя, а в другом — в роли в-теля.
- Никто не может гарантировать, что в экзаменационной задаче C1 вам обязательно встретится одно из этих веществ, но вероятность этого весьма высока.
- Важно не механическое запоминание формул, а ПОНИМАНИЕ. Попробуйте проверить себя: выпишите вперемешку вещества из двух списков, а затем попробуйте самостоятельно разделить их на типичные окислители и восстановители. Руководствуйтесь теми соображениями, которые мы обсуждали в начале этой статьи.
А теперь небольшая контрольная работа. Я предложу вам несколько неполных уравнений, а вы попробуете найти окислитель и восстановитель. Дописывать правые части уравнений пока не обязательно.
Пример 12 . Определите окислитель и восстановитель в ОВР:
CrO 3 + C 3 H 6 + H 2 SO 4 = .
Na 2 SO 3 + Na 2 Cr 2 O 7 + H 2 SO 4 = .
O 3 + Fe(OH) 2 + H 2 O = .
KMnO 4 + KNO 2 + KOH = .
H 2 O 2 + K 2 S + KOH = .
Думаю, вы справились с этим заданием без труда. Если же возникли проблемы, прочитайте еще раз начало этой статьи, поработайте над списком типичных окислителей.
«Все это чудесно! — воскликнет нетерпеливый читатель. — Но где же обещанные задачи С1 с неполными уравнениями? Да, в примере 12 мы смогли определить окислитель и в-тель, но ведь главное не в этом. Главное — суметь ДОПОЛНИТЬ уравнение реакции, а разве список окислителей сможет нам в этом помочь?»
Да, сможет, если понимать, ЧТО ПРОИСХОДИТ с типичными окислителями в различных условиях. Вот именно этим мы сейчас и займемся.
Шестой шаг : превращения некоторых окислителей в разных средах. «Судьба» перманганатов, хроматов, азотной и серной кислот
Итак, мы должны не только уметь распознавать типичные окислители, но и понимать, во что превращаются эти вещества в ходе ОВР. Очевидно, что без этого понимания мы не сможем правильно решить задачу 30. Ситуация усложняется тем, что продукты взаимодействия невозможно указать ОДНОЗНАЧНО. Бессмысленно спрашивать: «Во что превратится перманганат калия в ходе процесса восстановления?» Все зависит от множества причин. В случае KMnO 4 главная из них — это кислотность (pH) среды. В принципе, характер продуктов восстановления может зависеть от:
- используемого в ходе процесса восстановителя,
- кислотности среды,
- концентраций участников реакции,
- температуры процесса.
Мы не будем сейчас говорить о влиянии концентрации и температуры (хотя пытливые юные химики могут вспомнить, что, например, хлор и бром по-разному взаимодействуют с водным раствором щелочи на холоду и при нагревании). Сосредоточимся на рН среды и силе восстановителя.
Информацию, приведенную ниже, следует просто запомнить. Не надо пытаться анализировать причины, просто ЗАПОМНИТЕ продукты реакций. Уверяю вас, на ЕГЭ по химии это может вам пригодиться.
Продукты восстановления перманганата калия (KMnO 4 ) в различных средах
| Характер среды | Продукты восстановления |
| Кислая | Mn 2+ (соли марганца (II)) |
| Нейтральная | MnO 2 (оксид марганца (IV)) |
| Щелочная | MnO 4 2- (манганаты) |
Пример 13 . Дополните уравнения окислительно — восстановительных реакций:
Решение . Руководствуясь списком типичных окислителей и восстановителей, приходим к выводу, что окислителем во всех этих реакциях является перманганат калия, а восстановителем — сульфит калия.
H 2 SO 4 , H 2 O и КОН определяют характер раствора. В первом случае реакция идет в кислой среде, во втором — в нейтральной, в третьем — в щелочной.
Вывод: в первом случае перманганат будет восстановлен до соли Mn(II), во втором — до диоксида марганца, в третьем — до манганата калия. Дополним уравнения реакций:
А во что превратится сульфит калия? Ну, естественно, в сульфат. Очевидно, что К в составе K 2 SO 3 окислять дальше просто некуда, окисление кислорода крайне маловероятно (хотя, в принципе, возможно), а вот S(+4) легко превращается в S(+6). Продукт окисления — K 2 SO 4 , можно добавить эту формулу в уравнения:
Наши уравнения практически готовы. Осталось добавить вещества, которые непосредственно не участвуют в ОВР и расставить коэффициенты. Кстати, если начать со второго пункта, возможно, будет даже проще. Построим, например, электронный баланс для последней реакции
| Mn(+7) + 1e | = | Mn(+6) | (2) |
| S(+4) — 2e | = | S(+6) | (1) |
Ставим коэффициент 2 перед формулами KMnO 4 и K 2 MnO 4 ; перед формулами сульфита и сульфата калия подразумеваем коэфф. 1:
2KMnO 4 + KOH + K 2 SO 3 = 2K 2 MnO 4 + K 2 SO 4 + .
Справа видим 6 атомов калия, слева — пока только 5. Надо исправлять положение; ставим перед формулой КОН коэффициент 2:
2KMnO 4 + 2KOH + K 2 SO 3 = 2K 2 MnO 4 + K 2 SO 4 + .
Последний штрих: в левой части видим атомы водорода, справа их нет. Очевидно, надо срочно найти какое-то вещество, которое содержит водород в степени окисления +1. Давайте возьмем воду!
2KMnO 4 + 2KOH + K 2 SO 3 = 2K 2 MnO 4 + K 2 SO 4 + H 2 O
Проверяем еще раз уравнение. Да, все отлично!
«Интересное кино! — заметит бдительный юный химик. — А почему это вы добавили на последнем шаге именно воду? А если я захочу добавить перекись водорода или просто Н 2 или гидрид калия или Н 2 S? Вы добавили воду, т. к. ее НЕОБХОДИМО было добавить или вам просто так захотелось?»
Что же, давайте разбираться. Ну, во-первых, добавлять вещества в уравнение реакции по своему желанию мы, естественно не имеем права. Реакция идет именно так, как она идет; как распорядилась природа. Наши симпатии и антипатии не в силах повлиять на ход процесса. Мы можем попробовать изменить условия реакции (повысить температуру, добавить катализатор, изменить давление), но если условия реакции заданы, ее результат уже не может зависеть от нашей воли. Таким образом, формула воды в уравнении последней реакции — это не мое желание, а факт.
Во-вторых, вы, можете попробовать уравнять реакцию в случаях, когда вместо воды будут присутствовать перечисленные вами вещества. Уверяю вас: ни в одном случае вы не сможете этого сделать.
В-третьих, варианты с H 2 O 2 , Н 2 , KH или Н 2 S просто неприемлемы в данном случае по тем или другим причинам. Например, в первом случае меняется степень окисления кислорода, во втором и 3-м — водорода, а мы договорились, что степень окисления поменяется только у Mn и S. В четвертом случае сера вообще выступила в роли окислителя, а мы условились, что S — восстановитель. Кроме того, гидрид калия вряд ли «выживет» в водной среде (а реакция, напомню, идет в водном р-ре), а H 2 S (даже если бы это вещество и образовалось) неминуемо вступит в р-цию с КОН. Как видите, знание химии позволяет нам отвергнуть эти в-ва.
«Но почему именно вода?» — спросите вы.
Да, потому, например, что в данном процессе (как и во многих других) вода выступает в качестве растворителя. Потому, например, что если вы проанализируете все реакции, написанные вами за 4 года изучения химии, обнаружится, что Н 2 O встречается едва ли не в половине уравнений. Вода — вообще довольно «популярное» в химии соединение.
Поймите, я не утверждаю, что каждый раз, когда в задаче 30 вам надо «куда-то отправить водород» или «откуда-то взять кислород», необходимо хвататься за воду. Но, наверное, это будет первое вещество, о котором следует подумать.
Похожая логика используется для уравнений реакций в кислой и нейтральной средах. В первом случае необходимо добавить в правую часть формулу воды, во втором — гидроксида калия:
Расстановка коэффициентов у многоопытных юных химиков не должна вызвать ни малейших затруднений. Окончательный ответ:
В следующей части мы поговорим о продуктах восстановления хроматов и бихроматов, об азотной и серной кислотах.
Как решать химические уравнения — схемы и примеры решения для разных реакций
Основные термины и понятия
Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:
- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс
Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.
Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:
- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
Уравнение можно сократить на 16H + и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO — 3 + 4 H + = Fe3 + + 2SO 2- 4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта
Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
Урок 13. Составление химических уравнений
В уроке 13 «Составление химических уравнений» из курса «Химия для чайников» рассмотрим для чего нужны химические уравнения; научимся уравнивать химические реакции, путем правильной расстановки коэффициентов. Данный урок потребует от вас знания химических основ из прошлых уроков. Обязательно прочитайте об элементном анализе, где подробно рассмотрены эмпирические формулы и анализ химических веществ.
Химическое уравнение
В результате реакции горения метана CH4 в кислороде O2 образуются диоксид углерода CO2 и вода H2O. Эта реакция может быть описана химическим уравнением:
Попробуем извлечь из химического уравнения больше сведений, чем просто указание продуктов и реагентов реакции. Химичекое уравнение (1) является НЕполным и потому не дает никаких сведений о том, сколько молекул O2 расходуется в расчете на 1 молекулу CH4 и сколько молекул CO2 и H 2 O получается в результате. Но если записать перед соответствующими молекулярными формулами численные коэффициенты, которые укажут сколько молекул каждого сорта принимает участие в реакции, то мы получим полное химическое уравнение реакции.
Для того, чтобы завершить составление химического уравнения (1), нужно помнить одно простое правило: в левой и правой частях уравнения должно присутствовать одинаковое число атомов каждого сорта, поскольку в ходе химической реакции не возникает новых атомов и не происходит уничтожение имевшихся. Данное правило основывается на законе сохранения массы, который мы рассмотрели в начале главы.
Уравнивание химических реакций
Уравнивание химических реакций нужно для того, чтобы из простого химического уравнения получить полное. Итак, перейдем к непосредственному уравниванию реакции (1): еще раз взгляните на химическое уравнение, в точности на атомы и молекулы в правой и левой части. Нетрудно заметить, что в реакции участвуют атомы трех сортов: углерод C, водород H и кислород O. Давайте подсчитаем и сравним количество атомов каждого сорта в правой и левой части химического уравнения.
Начнем с углерода. В левой части один атом С входит в состав молекулы CH4, а в правой части один атом С входит в состав CO2. Таким образом в левой и в правой части количество атомов углерода совпадает, поэтому его мы оставляем в покое. Но для наглядности поставим коэффициент 1 перед молекулами с углеродом, хоть это и не обязательно:
Затем переходим к подсчету атомов водорода H. В левой части присутствуют 4 атома H (в количественном смысле H4 = 4H) в составе молекулы CH4, а в правой – всего 2 атома H в составе молекулы H2O, что в два раза меньше чем в левой части химического уравнения (2). Будем уравнивать! Для этого поставим коэффициент 2 перед молекулой H2O. Вот теперь у нас и в реагентах и в продуктах будет по 4 молекулы водорода H:
Обратите свое внимание, что коэффициент 2, который мы записали перед молекулой воды H2O для уравнивания водорода H, увеличивает в 2 раза все атомы, входящие в ее состав, т.е 2H2O означает 4H и 2O. Ладно, с этим вроде бы разобрались, осталось подсчитать и сравнить количество атомов кислорода O в химическом уравнении (3). Сразу бросается в глаза, что в левой части атомов O ровно в 2 раза меньше чем в правой. Теперь-то вы уже и сами умеете уравнивать химические уравнения, поэтому сразу запишу финальный результат:
Как видите, уравнивание химических реакций не такая уж и мудреная штука, и важна здесь не химия, а математика. Уравнение (4) называется полным уравнением химической реакции, потому что в нем соблюдается закон сохранения массы, т.е. число атомов каждого сорта, вступающих в реакцию, точно совпадает с числом атомов данного сорта по завершении реакции. В каждой части этого полного химического уравнения содержится по 1 атому углерода, по 4 атома водорода и по 4 атома кислорода. Однако стоит понимать пару важных моментов: химическая реакция — это сложная последовательность отдельных промежуточных стадий, и потому нельзя к примеру истолковывать уравнение (4) в том смысле, что 1 молекула метана должна одновременно столкнуться с 2 молекулами кислорода. Процессы происходящие при образовании продуктов реакции гораздо сложнее. Второй момент: полное уравнение реакции ничего не говорит нам о ее молекулярном механизме, т.е о последовательности событий, которые происходят на молекулярном уровне при ее протекании.
Коэффициенты в уравнениях химических реакций
Еще один наглядный пример того, как правильно расставить коэффициенты в уравнениях химических реакций: Тринитротолуол (ТНТ) C7H5N3O6 энергично соединяется с кислородом, образуя H2O, CO2 и N2. Запишем уравнение реакции, которое будем уравнивать:
Проще составлять полное уравнение, исходя из двух молекул ТНТ, так как в левой части содержится нечетное число атомов водорода и азота, а в правой — четное:
- 2C7H5N3O6 + O2 → CO2 + H2O + N2 (6)
Тогда ясно, что 14 атомов углерода, 10 атомов водорода и 6 атомов азота должны превратиться в 14 молекул диоксида углерода, 5 молекул воды и 3 молекулы азота:
Теперь в обеих частях содержится одинаковое число всех атомов, кроме кислорода. Из 33 атомов кислорода, имеющихся в правой части уравнения, 12 поставляются двумя исходными молекулами ТНТ, а остальные 21 должны быть поставлены 10,5 молекулами O2. Таким образом полное химическое уравнение будет иметь вид:
Можно умножить обе части на 2 и избавиться от нецелочисленного коэффициента 10,5:
Но этого можно и не делать, поскольку все коэффициенты уравнения не обязательно должны быть целочисленными. Правильнее даже составить уравнение, исходя из одной молекулы ТНТ:
Полное химическое уравнение (9) несет в себе много информации. Прежде всего оно указывает исходные вещества — реагенты, а также продукты реакции. Кроме того, оно показывает, что в ходе реакции индивидуально сохраняются все атомы каждого сорта. Если умножить обе части уравнения (9) на число Авогадро NA=6,022·10 23 , мы сможем утверждать, что 4 моля ТНТ реагируют с 21 молями O2 с образованием 28 молей CO2, 10 молей H2O и 6 молей N2.
Есть еще одна фишка. При помощи таблицы Менделеева определяем молекулярные массы всех этих веществ:
- C 7 H 5 N 3 O 6 = 227,13 г/моль
- O 2 = 31,999 г/моль
- CO 2 = 44,010 г/моль
- H 2 O = 18,015 г/моль
- N 2 = 28,013 г/моль
Теперь уравнение 9 укажет еще, что 4·227,13 г = 908,52 г ТНТ требуют для осуществления полной реакции 21·31,999 г = 671,98 г кислорода и в результате образуется 28·44,010 г = 1232,3 г CO2, 10·18,015 г = 180,15 г H2O и 6·28,013 г = 168,08 г N2. Проверим, выполняется ли в этой реакции закон сохранения массы:
| Реагенты | Продукты | |
| 908,52 г ТНТ | 1232,3 г CO 2 | |
| 671,98 г CO 2 | 180,15 г H 2 O | |
| 168,08 г N 2 | ||
| Итого | 1580,5 г | 1580,5 г |
Но необязательно в химической реакции должны участвовать индивидуальные молекулы. Например, реакция известняка CaCO 3 и соляной кислоты HCl, с образованием водного раствора хлорида кальция CaCl 2 и диоксида углерода CO 2 :
Химическое уравнение (11) описывает реакцию карбоната кальция CaCO3 (известняка) и хлористоводородной кислоты HCl с образованием водного раствора хлорида кальция CaCl2 и диоксида углерода CO2. Это уравнение полное, так как число атомов каждого сорта в его левой и правой частях одинаково.
Смысл этого уравнения на макроскопическом (молярном) уровне таков: 1 моль или 100,09 г CaCO3 требует для осуществления полной реакции 2 моля или 72,92 г HCl, в результате чего получается по 1 молю CaCl2 (110,99 г/моль), CO2 (44,01 г/моль) и H2O (18,02 г/моль). По этим численным данным нетрудно убедиться, что в данной реакции выполняется закон сохранения массы.
Интерпретация уравнения (11) на микроскопическом (молекулярном) уровне не столь очевидна, поскольку карбонат кальция представляет собой соль, а не молекулярное соединение, а потому нельзя понимать химическое уравнение (11) в том смысле, что 1 молекула карбоната кальция CaCO3 реагирует с 2 молекулами HCl. Тем более молекула HCl в растворе вообще диссоциирует (распадается) на ионы H + и Cl — . Таким образом более правильным описанием того, что происходит в этой реакции на молекулярном уровне, дает уравнение:
Здесь в скобках сокращенно указано физическое состояние каждого сорта частиц (тв. — твердое, водн. — гидратированный ион в водном растворе, г. — газ, ж. — жидкость).
Уравнение (12) показывает, что твердый CaCO3 реагирует с двумя гидратированными ионами H + , образуя при этом положительный ион Ca 2+ , CO2 и H2O. Уравнение (12) как и другие полные химические уравнения не дает представления о молекулярном механизме реакции и менее удобно для подсчета количества веществ, однако, оно дает лучшее описание происходящего на микроскопическом уровне.
Закрепите полученные знания о составлении химических уравнений, самостоятельно разобрав пример с решением:
Надеюсь из урока 13 «Составление химических уравнений» вы узнали для себя что-то новое. Если у вас возникли вопросы, пишите их в комментарии.
http://nauka.club/khimiya/khimicheskie-uravneniya.html
http://himi4ka.ru/arhiv-urokov/urok-13-sostavlenie-himicheskih-uravnenij.html