Теория ОГЭ по химии
Полный курс подготовки к ОГЭ по химии-2022. Здесь приведена теория по каждому заданию ОГЭ по химии в соответствии с кодификатором. Вся теория, необходимая для подготовки к ОГЭ по химии.
Кодификатор ОГЭ по химии-2022
| 1 | Вещество | |
| 1.1. | Строение электронных оболочек атомов элементов первых 20 элементов Периодической системы Д.И. Менделеева Тренировочные тесты в формате ЕГЭ по теме «Строение атома» (задание 1 ЕГЭ по химии) ( с ответами) |
| 1.2 | Периодический закон и Периодическая система химических элементов Д.И. Менделеева | |
| 1.2.1 | Группы и периоды Периодической системы. Физический смысл порядкового номера химического элемента | |
| 1.2.2 | ||
| Первоначальные химические понятия | ||
| 1.5 | Чистые вещества и смеси | |
| 1.6 | Атомы и молекулы. Химический элемент. Простые и сложные вещества. Относительная атомная и молекулярная масса | |
| 1.7 | Классификация и номенклатура неорганических веществ (тривиальная и международная) Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» (задание 5 ЕГЭ по химии) ( с ответами) | |
| 2 | Химическая реакция | |
| 2.1 | Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях | |
| 2.2 | Классификация химических реакций по различным признакам: количеству и составу исходных и полученных веществ, изменению степеней окисления химических элементов, поглощению и выделению энергии | |
| 2.3. | Электролиты и неэлектролиты | |
| 2.4. | Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей (средних) | |
| 2.5. | Реакции ионного обмена и условия их осуществления | |
| 2.6. | Окислительно-восстановительные реакции. Окислитель и восстановитель | |
| 2.7. | ||
| 2.8. | Взаимосвязь различных классов неорганических веществ | |
| 3. | Элементарные основы неорганической химии. Представления об органических веществах | |
| 3.1 | Химические свойства простых веществ | |
| 3.1.1 | Химические свойства простых веществ – металлов: щелочных, щелочноземельных, алюминия, железа. | |
| 3.1.2 | Химические свойства простых веществ – неметаллов: водорода , галогенов, кислорода, серы, азота, фосфора, углерода, кремния | |
| 3.2 | Химические свойства сложных веществ | |
| 3.2.1 | Получение и химические свойства оксидов: основных, амфотерных, кислотных | |
| 3.2.2 | Получение и химические свойства оснований. Химические свойства амфотерных гидроксидов алюминия и железа (III) | |
| 3.2.3 | Получение, применение и химические свойства кислот | |
| 3.2.4 | Химические свойства солей | |
| 3.3 | Генетическая связь между классами неорганических соединений | |
| 3.4 | Первоначальные сведения об органических веществах | |
| 3.4.1 | Углеводороды предельные и непредельные: метан, этан, этилен, ацетилен | |
| 3.4.2 | Кислородсодержащие вещества: спирты (метанол, этанол, глицерин), карбоновые кислоты (уксусная и стеариновая) | |
| 3.4. | Биологически важные вещества: белки, жиры, углеводы | |
| 4. | Методы познания веществ и химических явлений. Экспериментальные основы химии | |
| 4.1. | Экспериментальные основы химии | |
| 4.1 | Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Приготовление растворов с определённой массовой долей растворённого вещества | |
| 4.2 | Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак) | |
| 4.4 | Решение экспериментальных задач по темам «Неметаллы IV–VII групп и их соединений»; «Металлы и их соединения» Получение и изучение свойств изученных классов неорганических веществ | |
| 4.5 | Проведение расчётов на основе формул и уравнений реакций | |
| 4.5.1 | Вычисление массовой доли химического элемента в веществе | |
| 4.5.2 | Вычисление массовой доли растворённого вещества в растворе | |
| 4.5.3 | Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции | |
| 5. | Химия и жизнь | |
| 5.1 | Проблемы безопасного использования веществ и химических реакций в повседневной жизни | |
| 5.2 | Химическое загрязнение окружающей среды и его последствия | |
| 5.3 | Человек в мире веществ, материалов и химических реакций Токсичные, горючие и взрывоопасные вещества |
Спецификация ОГЭ по химии-2022
Часть 1
Задание 1. Атомы и молекулы. Химический элемент. Простые и сложные вещества
Задание 8. Химические свойства простых веществ. Химические свойства оксидов: основных, амфотерных, кислотных
Задание 9. Химические свойства простых веществ. Химические свойства сложных веществ
Задание 10. Химические свойства простых веществ. Химические свойства сложных веществ
Задание 12. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения.
Сохранение массы веществ при химических реакциях
Задание 17. Определение характера среды раствора кислот и щёлочей с помощью индикаторов. Качественные реакции на ионы в растворе (хлорид-, сульфат-, карбонат-, фосфат-, гидроксид- ионы; ионы аммония, бария, серебра, кальция, меди и железа). Получение газообразных веществ. Качественные реакции на газообразные вещества (кислород, водород, углекислый газ, аммиак).
Задание 18. Вычисление массовой доли химического элемента в веществе.
Часть 2
Задание 21. Взаимосвязь различных классов неорганических веществ. Реакции ионного обмена и условия их осуществления.
Задание 22. Вычисление количества вещества, массы или объёма вещества по количеству вещества, массе или объёму одного из реагентов или продуктов реакции. Вычисление массовой доли растворённого вещества в растворе.
Практическая часть
Задание 23. Решение экспериментальных задач по теме «Неметаллы IV–VII групп и их соединений»; «Металлы и их соединения». Качественные реакции на ионы в растворе (хлорид-, иодид-, сульфат-, карбонат-, силикат-, фосфат-; ион аммония; катионы изученных металлов, а также бария, серебра, кальция, меди и железа).
Задание 24. Правила безопасной работы в школьной лаборатории. Лабораторная посуда и оборудование. Разделение смесей и очистка веществ. Приготовление растворов.
Добавить комментарий
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.
Все уравнения реакций по химии для огэ
Какое уравнение соответствует реакции разложения?
1)
2)
3)
4)
Рассмотрим каждую реакцию:
1) реакция разложения
2) реакция обмена
3) реакция замещения
4) реакция замещения
Правильный ответ указан под номером 1.
Какое уравнение соответствует реакции обмена?
1)
2)
3)
4)
Рассмотрим каждую реакцию:
1) реакция замещения
2) реакция замещения
3) реакция обмена
4) реакция соединения
Правильный ответ указан под номером 3.
Аналоги к заданию № 50: 2225 Все
Какое уравнение соответствует реакции замещения?
1)
2)
3)
4)
Рассмотрим каждую реакцию:
1) реакция обмена
2) реакция соединения
3) реакция замещения
4) реакция разложения
Правильный ответ указан под номером 3.
Аналоги к заданию № 72: 4801 Все
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает
1)
2)
3)
4)
В реакцию разложения, сопровождающуюся изменением степени окисления, вступает перманганат калия:
Правильный ответ указан под номером 4.
Гидроксид магния-нерастворимое основание(осадок)и оно раскладывается под температурой на оксид мет.и воду.
Кристина, но при этом не изменяется степень окисления.
В реакцию замещения вступают между собой
1) и
2) и
3) и
4) и
Реакция замещения − это реакция простого вещества со сложным, в результате которой получаются другое простое вещество и другое сложное. Из представленных вариантов простое вещество есть только в варианте 3.
В помощь сдающим ОГЭ по химии
Данное пособие поможет при подготовке к экзамену по химии для учащихся 9 классов.
Просмотр содержимого документа
«В помощь сдающим ОГЭ по химии»
В помощь сдающим ОГЭ
методическое пособие по химии
для учащихся 9-х классов,
Тема №1: «Строение атомов первых 20 химических элементов
ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Строение атома: ядро (протоны и нейтроны) + электроны.
Число протонов (p + ) – равно порядковому номеру химического элемента (Z).
Число нейтронов (n 0 ) – равно A-Z, где А – массовое число.
Число электронов (е — ) — равно порядковому номеру химического элемента (Z).
Заряд ядра = число протонов = число электронов (+Z = p + = е — ).
Номер периода показывает – число электронных слоев в электронной оболочке атома.
Номер группы показывает – число электронов на внешнем электронном слое атома + число валентных электронов.
Валентные электроны – электроны, участвующие в образовании химической связи.
Распределение электронов по энергетическим уровням: на 1-м максимум 2 электрона, на 2-м – 8 электронов, на 3-м – 18 электронов (если уровень последний – то число электронов на нём равно номеру группы или высчитывается как разница общего числа электронов и электронов на предыдущих уровнях). Если последний (внешний) уровень атома имеет максимальное число электронов, то такой электронный слой называется завершенным (его имеют атомы благородных газов – элементы 8 группы).
Тема №2: «Периодический закон и ПСХЭ Д. И. Менделеева».
Обязательный минимум знаний.
Закономерности изменения свойств элементов и их соединений.
В периоде слева направо:
Радиус атома уменьшается;
Металлические свойства ослабевают;
Неметаллические свойства возрастают;
Восстановительные свойства ослабевают;
Окислительные свойства возрастают;
Число валентных электронов возрастает;
Основные оксиды через амфотерные сменяются кислотными.
В группе сверху вниз:
Радиус атома возрастает;
Металлические свойства возрастают;
Неметаллические свойства ослабевают;
Восстановительные свойства возрастают;
Окислительные свойства ослабевают;
Число валентных электронов постоянно и равно номеру группы.
Тема №3: «Химическая связь».
Обязательный минимум знаний.
Типы химических связей:
Ковалентная полярная химическая связь (образуется между атомами неметаллов с разным значением электроотрицательности или между атомами металла и неметалла с небольшой разностью в значении электроотрицательности). Например: H2S, NH3.
Ковалентная неполярная химическая связь (образуется между атомами неметаллов с одинаковым значением электроотрицательности). Например: H2, O2, P4, S8.
Ионная химическая связь (образуется между атомами неметалла и металла). Например: NaCl, CaO, K2S.
Металлическая химическая связь – характерна для металлов и сплавов. Например: Al, Cu, бронза, чугун, латунь.
Тема №4: «Степень окисления химических элементов».
Обязательный минимум знаний.
Правила расчета степени окисления:
С.о. водорода = +1 в соединениях с неметаллами и = -1 в соединениях с металлами (гидриды металлов);
С.о. кислорода = -2, кроме пероксидов (-1) и фторидов (+2);
С.о. металла = заряду его иона (в таблице растворимости);
С.о. простого вещества = 0;
Сумма с.о. всех элементов в сложном веществе = 0;
С.о. иона = заряду иона (в таблице растворимости).
Алгоритм определения степени окисления элементов в бинарных соединениях:
Выбрать более электроотрицательный элемент и найти его степень окисления, как № группы – 8. Написать над ним степень окисления.
Умножить степень окисления на индекс у этого элемента. Полученное число со знаком «минус» подписать под другим элементом.
Такое же число со знаком «плюс» подписать под другим элементом.
Разделить это число на индекс другого элемента. Полученную степень окисления написать над элементом.
Алгоритм определения степени окисления неметалла в кислотах и солях:
Отделить кислород вертикальной чертой, записать сверху его степень окисления – 2 и умножить на индекс. Полученное число написать под кислородом.
Такое же число с противоположным знаком записать под левой частью формулы.
Вычесть из него число атомов водорода (для кислот) или заряд металла*индекс металла (для солей). Полученное число написать над знаком центрального элемента.
Тема №5: «Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура органических соединений».
Обязательный минимум знаний.
Металлы Неметаллы Оксиды Основания Кислоты Соли
Оксиды – бинарные соединения кислорода, в котором он проявляет степень окисления –2 (CaO, Al2O3).
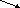
основные амфотерные кислотные
Несолеобразующие оксиды – не взаимодействуют с кислотами и щелочами и, как следствие, не образуют солей. Основные оксиды – образованы металлом в с.о.+1 и +2 (Na2O, MgO). Амфотерные оксиды – образованы металлами в с.о. +3 и +4 (Al2O3, PbO2). Исключения: ZnO, PbO, SnO, BeO (у них с.о. металла равна +2). Кислотные оксиды – образованы металлом в с.о.+5,+6,+7 или неметаллов, исключая несолеобразующие (SO3, CO2).
Основания – сложные соединения, в составе которых катион металла соединен с гидроксид-анионами: Me(OH)n. Например: NaOH, Ca(OH)2. Основания могут быть растворимыми и нерастворимыми. Растворимые в воде основания – щелочи (они окрашивают индикаторы).
Кислоты – сложные соединения, в составе которых атом водорода соединен с кислотным остатком (HCl, H2SO4). Кислотный остаток может состоять из одного элемента (Cl — ) и быть сложным (SO4 — ).
Соли – сложные вещества, в составе которых катион металла соединен с кислотным остатком (NaCl, CaSO4).
http://chem-oge.sdamgia.ru/test?theme=6
http://multiurok.ru/files/v-pomoshch-sdaiushchim-oge-po-khimii.html



