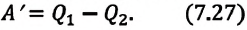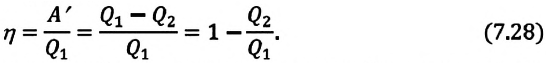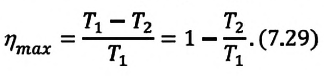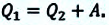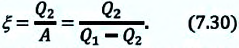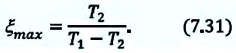Необратимость тепловых процессов. Второй закон термодинамики. Понятие энтропии
Первый закон термодинамики – закон сохранения тепловых процессов, устанавливающий связь между количеством теплоты Q и изменением ∆ U внутренней энергии и работой А , совершенной над внешними телами:
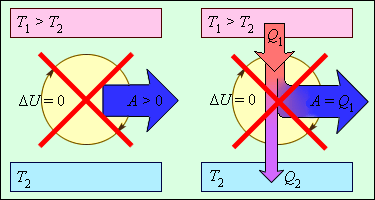
Исходя из закона, энергия не может быть создана или уничтожена: производится процесс передачи от одной системы к другой, принимая другую форму. Еще не было получено процессов, нарушающих первый закон термодинамики. Рисунок 3 . 12 . 1 показывает устройства, противоречащие первому закону.
Рисунок 3 . 12 . 1 . Циклически работающие тепловые машины, запрещаемые первым законом термодинамики: 1 – вечный двигатель 1 рода, совершающий работу без потребления энергии извне; 2 – тепловая машина с коэффициентом полезного действия η > 1 .
Обратимый и необратимый процессы
Первый закон термодинамики не устанавливает направления тепловых процессов. Опыты показывают, что большинство тепловых процессов протекают в одном направлении. Их называют необратимыми.
Если имеется тепловой контакт двух тел с разными температурами, тогда направление теплового потока направляется от теплого к холодному. Самопроизвольной передачи тепла от тела с низкой температуры к телу с высокой не наблюдается. Отсюда следует, что теплообмен с конечной разностью температур считается необратимым.
Обратимым процессом называется переход системы из одного равновесного расстояния в другое, которые возможно проводить в обратном направлении в той же последовательности промежуточных равновесных состояний. Она вместе с окружающими телами возвращаются к исходному состоянию.
Если система находится в состоянии равновесия во время процесса, она называется квазистатической.
Когда рабочее тело тепловой машины контактирует с тепловым резервуаром, температура которого неизменна во время всего процесса, то только изотермический квазистатический процесс считается обратимым, так как протекает с бесконечно малой разницей температур рабочего резервуара. Если имеется два резервуара, причем с разными температурами, тогда обратимым путем можно провести процессы на двух изотермических участках.
Так как адиабатический процесс проводится в обоих направлениях (сжатие и расширение), наличие кругового процесса с двумя изотермами и двумя адиабатами (цикл Карно) говорит о том, что это и есть единственный обратимый круговой процесс, где рабочее тело контактируется с двумя тепловыми резервуарами. Остальные при наличии 2 тепловых резервуаров считаются необратимыми.
Превращение механической работы во внутреннюю энергию считаются необратимыми при наличии силы трения, диффузии в газах и жидкостях, а процесс перемешивания по причине начальной разности давлений и так далее. Все реальные процессы считаются необратимыми, даже если значения будут максимально приближены к обратимым. Обратимые рассматриваются как пример реальных процессов.
Первый закон термодинамики не различает их. Правило требует от термодинамического процесса определенного энергетического баланса, но не говорит о том, возможен ли он. Установка направления прохождения процесса определяется вторым законом термодинамики. Его формулировка может звучать как запрет на определенные термодинамические процессы.
Второй закон был трактован У. Кельвином в 1851 .
В циклически действующей тепловой машине невозможно прохождение процесса, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от единственного теплового резервуара.
Предположительно, машина с такими процессами могла бы получить название вечного двигателя второго рода.
При земных условиях могла бы быть отбита энергия Мирового океана и полностью превратилась бы в ее работу. Масса воды Мирового океана – 10 21 к г . Для его охлаждения хотя бы на 1 градус потребуется огромное количество энергии ≈ 10 24 Д ж , которое сравнимо с сжиганием 10 17 к г угля. Вырабатываемая энергия на Земле за год в 10 4 раз меньше. Отсюда и вывод о том, что вечный двигатель второго рода мало вероятен, как и двигатель первого, потому как оба они недопустимы, исходя из первого закона термодинамики.
Второй закон термодинамики
Формулировка 2 -го закона термодинамики была дана физиком Р. Клаузиусом.
Невозможно прохождение процесса, единственным результатом которого была бы передача энергии при помощи теплообмена от тела с низкой температуры к телу с более высокой.
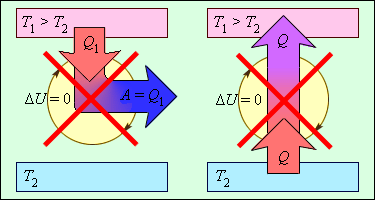
Рисунок 3 . 12 . 2 объясняет процессы, которые запрещены вторым законом, но разрешены согласно первому. Они соответствуют трактовкам второго закона термодинамики.
Рисунок 3 . 12 . 2 . Процессы, не противоречащие первому закону термодинамики, но запрещаемые вторым законом: 1 – вечный двигатель второго рода; 2 – самопроизвольный переход тепла от холодного тела к более теплому (идеальная холодильная машина).
Формулировки обоих законов считаются эквивалентными.
Когда тело без помощи внешних сил переходит при теплообмене от холодного к горячему, то возникает мысль о возможности создания вечного двигателя второго рода. Если такая машина получит количество теплоты Q 1 от нагревателя и отдаст холодильнику Q 2 , тогда совершается работа A = Q 1 — Q 2 . Если бы Q 2 самопроизвольно перешло к нагревателю, то конечный результат тепловой машины и идеальной холодильной машины выглядело бы таким образом Q 1 — Q 2 . Причем сам переход происходил бы без изменений холодильника. Отсюда вывод – комбинация тепловой машины и идеальной холодильной машины равноценна двигателю второго рода.
Прослеживается связь между вторым законом термодинамики и необратимостью реальных тепловых процессов. Энергия теплового движения молекул отлична от механической, электрической и так далее. Она способна превратиться в другой вид энергии только частично. Поэтому при наличии энергии теплового движения молекул любой процесс считается необратимым, так как полностью в обратном направлении он не осуществим.
Свойство, относящееся к необратимым процессам, говорит о том, что они проходят в термодинамически неравновесной системе, а результат получается в виде замкнутой системы, приближающейся к состоянию термодинамического равновесия.
Теоремы Карно
Имеются теоремы Карно, которые могут быть доказаны, исходя из второго закона термодинамики.
КПД тепловой машины, работающей при данных значениях температур нагревателя холодильника, не может иметь значение больше, чем КПД действия машины, работающей согласно обратимому циклу Карно с теми же значениями температур нагревателя и холодильника.
КПД действия тепловой машины, работающей по циклу Карно, не зависит от рода рабочего тела, а только от температур нагревателя и холодильника.
Отсюда следует, что КПД действия машины с циклом Карно считается максимальным.
η = 1 — Q 2 Q 1 ≤ η m a x = η К а р н ю = 1 — T 2 T 1 .
Знак равенства данной записи говорит об обратимости процесса. Если машина работает по циклу Карно, тогда:
Q 2 Q 1 = T 2 T 1 или Q 2 T 2 = Q 1 T 1 .
Знаки Q 1 и Q 2 всегда отличаются независимо от направления цикла. Поэтому получаем:
Q 1 T 1 + Q 2 T 2 = 0 .
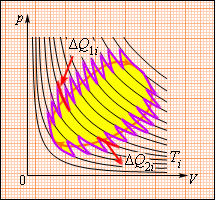
Рисунок 3 . 12 . 3 говорит о том, что данное соотношение обобщается и представляется в виде последовательности малых изометрических и адиабатических участков.
Рисунок 3 . 12 . 3 . Произвольный обратимый цикл как последовательность малых изотермических и адиабатических участков.
Полный обход замкнутого обратимого цикла имеет вид:
∑ ∆ Q i T i = 0 (обратимый цикл).
Откуда ∆ Q i = ∆ Q 1 i + ∆ Q 2 i – количество теплоты, полученное рабочим телом на двух изотермических участках с температурой T i . Чтобы данный цикл провести наоборот, нужно рабочее тело сконтактировать со многими тепловыми резервуарами с T i .
Энтропия
Отношение Q i T i получило название приведенного тепла. Формула показывает, что полное приведенное тепло на любом обратимом цикле равно нулю. Благодаря ей вводится еще одно понятие – энтропия, обозначаемая S . Ее открыл Р. Клаузиус в 1865 году.
При переходе из одного равновесного состояние в другое изменяется и ее энтропия. Разность энтропий двух состояний равняется приведенному теплу, полученному системой во время обратного перехода состояния.
∆ S = S 2 — S 1 = ∑ ( 1 ) ( 2 ) ∆ Q i о б р T .
Если рассматривается адиабатический процесс ∆ Q i = 0 , тогда энтропия S не изменяется.
Изменение энтропии ∆ S во время перехода в другое состояние фиксируется как формула:
∆ S = ∫ ( 1 ) ( 2 ) d Q о б р T .
Определение энтропии достаточно точное. Разность ∆ S двух состояний системы подразумевает физический смысл. Если имеется необратимый переход, а необходимо найти энтропию, тогда нужно придумать обратимый процесс, который свяжет начальное и конечное состояние. После этого перейти к нахождению приведенного тепла, полученного системой.
Рисунок 3 . 12 . 4 Модель энтропии и фазовых переходов.
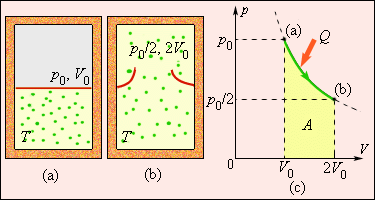
Рисунок 3 . 12 . 5 показывает необратимый процесс расширения шага с отсутствием теплообмена. Равновесными считаются начальное и конечное значение, изображаемые на диаграмме p , V . Точки a и b соответствуют состояниям и располагаются на одной изотерме. Чтобы найти ∆ S , следует перейти к рассмотрению обратимого изотермического перехода из a в b . При изопроцессе газ получает определенное количество теплоты окружающих тел Q > 0 , тогда при необратимом расширении энтропия возрастет до ∆ S > 0 .
Рисунок 3 . 12 . 5 . Расширение газа в «пустоту». Изменение энтропии ∆ S = Q T = A T > 0 где A = Q – работа газа при обратимом изотермическом расширении.
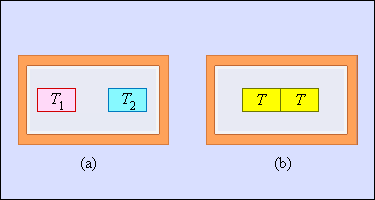
Еще одним примером необратимого процесса считается теплообмен при конечной разности температур. Рисунок 3 . 12 . 6 и показывает два тела, заключенные в адиабатическую оболочку, где начальные температуры обозначаются как T 1 и T 2 T 1 . Течение процесса теплообмена способствует выравниванию температур. Очевидно, что теплое тело отдает, а холодное принимает. Холодное тело превосходит по модулю приведенное тепло, отдаваемое горячим. Отсюда вывод – изменение энтропии в замкнутой системе необратимого процесса ∆ S > 0 .
Рисунок 3 . 12 . 6 . Теплообмен при конечной разности температур: a – начальное состояние; b – конечное состояние системы. Изменение энтропии Δ S > 0 .
Все самопроизвольно протекающие процессы в изолированных термодинамических процессах характеризуются ростом энтропии.
Обратимые процессы имеют постоянную энтропию ∆ S ≥ 0 . Соотношение называют законом возрастания энтропии.
При любых процессах, протекающих в термодинамических изолированных системах, энтропия либо не меняется, либо возрастает.
Наличие энтропии говорит о самопроизвольно протекающем процессе, а ее рост – приближение всей системы к термодинамическому равновесию, где S принимает максимальное значение. Возрастание энтропии можно трактовать как формулировку второго закона термодинамики.
В 1878 году Л. Больцман дал вероятностное определение понятию энтропии, так как было предложено рассматривать ее в качестве меры статистического беспорядка замкнутой термодинамической системы. Все самопроизвольно протекающие процессы в таких системах приближают ее к равновесному состоянию, так как сопровождаются ростом энтропии, и направляют в сторону увеличения вероятности состояния.
Если состояние макроскопической системы содержит большое число частиц, то его реализация может предусматривать несколько способов.
Термодинамическая вероятность W системы – это количество способов, которыми реализуется данное состояние макроскопической системы, макросостояний, осуществляющих его.
Из определения имеем, что W ≫ 1 .
При наличии 1 м о л ь газа в емкости существует число N способов размещения молекулы по двум половинам емкости: N = 2 N А , где N А — число Авогадро. Каждое из них – это микросостояние.
Одно из них соответствует случаю с молекулами, собранными в одной половине сосуда. Вероятность такого события приравнивается к нулю. Большое количество состояний соответствует такому, где молекулы распределяются равномерно по всей площади емкости.
Тогда равновесное состояние является наиболее вероятным.
Равновесное состояние считается состоянием наибольшего беспорядка в термодинамической системе с максимальной энтропией.
Исходя из трактовок Больцмана, энтропия S и термодинамическая вероятность W связаны:
S = k · ln W , где k = 1 , 38 · 10 — 23 Д ж / К является постоянная Больцмана. Отсюда следует, что определение энтропии определяется логарифмом числа микросостояний. Именно они способствуют реализации данного макросостояния. Тогда энтропия может быть рассмотрена в качестве меры вероятности состояния термодинамической системы.
Вероятностная трактовка второго закона термодинамики допускает самопроизвольное отклонение системы от состояния термодинамического равновесия. Их называют флуктуациями.
В системах с большим числом частиц отклонения от состояния равновесия имеют достаточно малую вероятность на существование.
Второй закон термодинамики. Необратимые процессы.
Необратимый процесс.
Необратимым называется физический процесс, который может самопроизвольно протекать только в одном определенном направлении.
В обратном направлении такие процессы могут протекать только как одно из звеньев более сложного процесса.
Необратимыми являются практически все процессы, происходящие в природе. Это связано с тем, что в любом реальном процессе часть энергии рассеивается за счет излучения, трения и т. д. Например, тепло, как известно, всегда переходит от более горячего тела к более холодному — это наиболее типичный пример необратимого процесса (хотя обратный переход не противоречит закону сохранения энергии).
Также висящий на легкой нити шарик (маятник) никогда самопроизвольно не увеличит амплитуду своих колебаний, наоборот, приведенный однажды в движение посторонней силой, он обязательно, в конце концов, остановится в результате сопротивления воздуха и трения нити о подвес. Таким образом, сообщенная маятнику механическая энергия переходит во внутреннюю энергию хаотического движения молекул (воздуха, материала подвеса).
Математически необратимость механических процессов выражается в том, что уравнение движения макроскопических тел изменяется с изменением знака времени: они не инвариантны при замене t на —t. При этом ускорение и силы, зависящие от расстояний, не изменяют свои знаки. Знак при замене t на —t меняется у скорости 
Направленность процессов в природе указывает второй закон термодинамики.
Второй закон термодинамики.
Второй закон термодинамики — один из основных законов термодинамики, устанавливающий необратимость реальных термодинамических процессов.
Второй закон термодинамики был сформулирован как закон природы Н. Л. С. Карно в 1824 г., затем У. Томсоном (Кельвином) в 1841 г. и Р. Клаузиусом в 1850 г. Формулировки закона различны, но эквивалентны.
Немецкий ученый Р. Клаузиус формулировал закон так: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или окружающих телах. Это означает, что теплота не может самопроизвольно переходить от более холодного тела к более горячему (принцип Клаузиуса).
Согласно формулировке Томсона процесс, при котором работа переходит в тепло без каких-либо иных изменений состояния системы, необратим, т. е. невозможно преобразовать в работу все тепло, взятое от тела, не производя никаких других изменений состояния системы (принцип Томсона).
Второй закон термодинамики — формулы и определение с примерами
Содержание:
Второй закон термодинамики:
Иногда можно встретить такие механические явления, в которых процесс протекает одинаково как в прямом, так и в обратном направлении. Например, сняв на видео повторяющиеся колебательные движения математического или пружинного маятника, происходящие за небольшой промежуток времени, и продемонстрировав явление в обратном направлении, можно увидеть, что колебания, происходящие в обратном направлении, в точности повторяют колебания, происходящие в прямом направлении.
Однако все естественные явления, происходящие в природе, можно сказать, однонаправленные; например, рост растений, падение массы воды в водопаде, старение человека и другие. Также имеется определенная направленность явлений в повседневной жизни, в которых мы участвуем; например, мяч после удара футболиста сначала ускоряется, а затем, замедляясь, останавливается; или падающий с высоты камень, ударившись о землю, останавливается, кипящая вода в чайнике, оставленном без внимания на кухне, полностью превращается в пар и др.
Второй закон термодинамики
Первый закон термодинамики — это закон сохранения энергии для тепловых процессов. Этот закон подтверждает невозможность создания вечного двигателя первого рода. Однако этот закон не определяет, в каком направлении протекают тепловые процессы. Например, приведем в соприкосновение друг с другом два тела с разными температурами. Через некоторый промежуток времени между ними установится тепловое равновесие, то есть выполняется первый закон термодинамики — какое количество теплоты отдаст более горячее тело, такое же количество теплоты получит более холоднее тело. Если бы этот процесс произошел наоборот, то есть холодное тело самопроизвольно (без внешнего вмешательства) передало бы количество теплоты горячему телу, то первый закон термодинамики также бы выполнялся. Однако ни один из экспериментов, проводимых учеными в течение веков, не установил протекание этого процесса самопроизвольно.
Другими словами, процесс теплопередачи в термодинамической системе, имеющий конечное значение разности изменения температур, необратим. Эта идея, сформулированная немецким ученым Р.Клаузиусом (1822-1888) в 1850 году, лежит в основе второго закона термодинамики:
Невозможен процесс, результатом которого является только самопроизвольный переход количества теплоты от холодного тела к теплому. Тепловая энергия самопроизвольно может передаваться только в направлении теплового равновесия, то есть от теплого тела к холодному.
Второй закон термодинамики определяет закономерность направления термодинамического процесса. Он показывает, что процесс передачи тепла от холодного тела к теплому не может протекать самопроизвольно, этот процесс можно реализовать в результате совершения работы.
В дальнейших исследованиях было определено, что не только тепловые процессы, но и вообщем, все естественные процессы, происходящие в природе, необратимы.
Необратимый процесс — это процесс, самопроизвольное протекание которого в противоположном направлении невозможно.
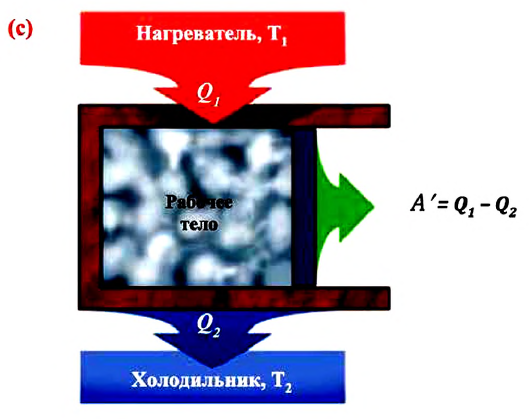
Принцип работы теплового двигателя
Принцип работы тепловых машин основан на применении второго закона термодинамики и составляет его научную основу.
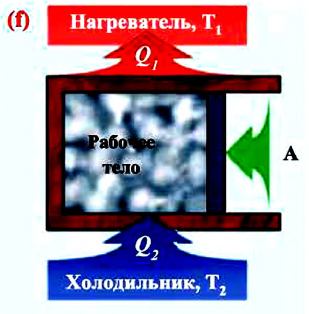
Тепловая машина — это термодинамическая система, выполняющая циклический процесс (совершающая механическую работу), передавая количество теплоты от одного тела другому.
Тепловые машины бывают двух видов: тепловые двигатели и холодильные установки.
Тепловым двигателем называется установка, преобразующая внутреннюю энергию различного вида топлива в механическую энергию.
Независимо от особенностей строения, все тепловые двигатели состоят из трех основных частей:
- Нагреватель — это часть двигателя, сохраняющая постоянную высокую температуру
- Рабочее тело — это газ или пар, совершающий механическую работу в результате расширения-сжатия.
- Холодильник — это часть двигателя с температурой
Принципиальная схема работы теплового двигателя следующая: рабочее тело получает от нагревателя количество теплоты 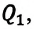
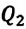
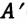
Для непрерывной работы теплового двигателя процесс, происходящий в двигателе, должен быть циклическим. С этой целью двигатель регулируется, так, чтобы рабочее тело (газ), вначале расширившись после получения количества теплоты, толкает поршень в цилиндре и совершает работу над ним, а затем, сжимаясь, возвращается в первоначальное состояние. После этого газ снова расширяется, и процесс циклически повторяется (трение подвижных частей двигателя и теплообмен с окружающей средой сводится до минимума) (см.: с).
В 1851 году английский ученый Уильям (Кельвин) Томсон (1824-1907), изучив принцип работы теплового двигателя, дал новое прочтение II закона термодинамики:
Тепловой двигатель, выполняющий циклический процесс, без холодильника работать не может.
Действительно, количество теплоты 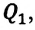
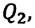
Коэффициентом полезного действия 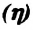
Невозможность работы теплового двигателя без холодильника приводит к тому, что их КПД всегда меньше 100%. Это значит, что II закон термодинамики подтверждает невозможность создания вечного двигателя второго рода (регреtuum mobile II):
Вечный двигатель второго рода (регреtuum mobile II) — это двигатель, превращающий полностью количество теплоты, полученное от нагревателя, в полезную работу.
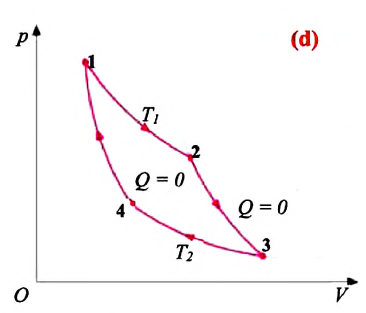
В 1824 году французский инженер Сади Карно (1796-1832) разработал теорию принципа работы идеального теплового двигателя (двигатель, принцип работы которого подчиняется газовым законам). По этой теории, максимальное КПД идеального теплового двигателя зависит только от абсолютных температур нагревателя и холодильника:
Из выражения (7.29) видно, что для увеличения КПД двигателя необходимо повышение температуры нагревателя и понижения температуры холодильника.
Циклический процесс, реализуемый идеальным тепловым двигателем, состоит из двух изотерм и двух адиабат и называется циклом Карно (d). Для тепловых двигателей этот цикл называется прямым циклом.
Принцип работы холодильных установок
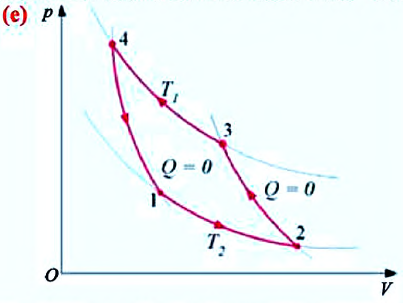
Для работы двигателя в режиме холодильной установки должен выполняться процесс, обратный циклу Карно — обратный цикл (е).
Из схемы превращения энергии в холодильной установке видно, что рабочее тело, расширяясь, получает от холодильной камеры определенное количество теплоты 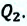
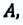
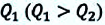
Таким образом, процесс передачи количества теплоты от холодного тела к теплому в термодинамической системе происходит не самостоятельно, а в результате совершения работы внешними силами.
Важной характеристикой холодильной установки является коэффициент охлаждения.
Коэффициентом охлаждения 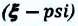
Коэффициент охлаждения идеальной холодильной установки:
| Рекомендую подробно изучить предметы: |
|
| Ещё лекции с примерами решения и объяснением: |
- Тепловые двигатели и их КПД
- Тепловое состояние тел
- Изменение агрегатного состояния вещества
- Электродинамика
- Адиабатический процесс
- Молекулярно-кинетическая теория
- Работа в термодинамике
- Первый закон термодинамики
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
http://www.calc.ru/Vtoroy-Zakon-Termodinamiki-Neobratimyye-Protsessy.html
http://www.evkova.org/vtoroj-zakon-termodinamiki