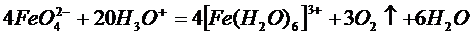Вулкан беттгера уравнение реакции сумма коэффициентов
Химия – наука экспериментальная, эксперимент учит на практике проверять свои выводы. Ломоносов говорил: «Химии никоим образом научиться невозможно, не видав самой практики и не принимаясь за химические операции»
Мы выбрали следующий опыт
(Возможности ресурса смотри приложение: презентация с фотографиями рабочего окна ресурса)
1.Познакомить с признаками и условиями течения химических реакций(экзотермическое разложение, окислительно-восстановительная реакция).
2.Пробудить у учащихся интерес к химии и показать, что эта наука является не только теоретической.
3.Создать условия для развития у учащихся умения анализировать результаты лабораторных исследований.
(Также целью этого опыта может быть получение оксида хрома (III) Cr2O3)
Техника безопасности . В отличие от физических явлений при химических явлениях, или химических реакциях, происходит превращение одних веществ в другие, образуются новые вещества, обладающие другими свойствами. Об этом можно судить по внешним признакам. Эти признаки называются признаками химических реакций. Помните, что любые химические опыты требуют при выполнении осторожности, внимания, аккуратности. Избежать неприятностей поможет соблюдение простых правил:
Опыт следует выполнять в вытяжном шкафу при включенной вентиляции (или на открытом воздухе). Внимание! На время опыта следует надеть защитные очки! Происходит бурное выбрасывание продуктов разложения! Не наклоняться над «вулканом», не вдыхать аэрозоль оксида хрома. Исходное вещество и продукт реакции ядовиты при попадании внутрь. Не брать вещества руками, после опыта вымыть руки!
Приборы и реактивы : фарфоровая ступка, асбестовая бумага или металлическая пластинка , стеклянная палочка ; спички; дихромат аммония (NH4)2Cr2O7 (измельченный), этиловый спирт.
Для проведения опыта химический «вулкан» растираем тщательно в фарфоровой ступке 50 г кристаллов дихромат аммония (NH4)2Cr2O7. Чтобы было легче собрать продукт реакции, следует застелить прилегающую к месту опыта поверхность листом фильтровальной бумаги.
Далее на лист асбестовой бумаги или металлическую пластинку насыпают (NH4)2Cr2O7 таким образом, чтобы образовалась форма горки. Палочкой на вершине горки делаем отверстие и вливаем в него несколько миллилитров этилового спирта (С2Н5ОН). Поджигаем спирт спичкой, спирт загорается и начинается процесс бурного разложения аммония дихромата.
При этом из «кратера» выбрасываются яркие искры и «вулканический пепел» — грязно-зеленый Cr2O3, при этом объем его во много раз превышает объем взятого аммоний дихромата:
Экзотермическое разложение (NH4)2Cr2O7 очень напоминает извержение настоящего вулкана, особенно на заключительной стадии, когда снопы красных искр прорываются из глубины пушистого Cr2O3.
Реакция разложения дихромата аммония протекает с выделением большого количества тепла, поэтому после поджигания соли она протекает самопроизвольно — до тех пор, пока весь дихромат не разложится.
Вывод : оксид хрома (III) Cr2O3 получается путем нагревания дихромата аммония. Реакция разложения дихромата аммония относится к окислительно-восстановительным реакциям. Она начинается после предварительного нагревания, протекает бурно, с выделением большого количества теплоты. Наблюдается выделение газа, образование раскаленных частиц оксида хрома (III). Потоком газа раскаленные частицы оксида хрома (III) увлекаются вверх. Разрушение кристаллов дихромата аммония сопровождается характерным потрескиванием. t (NH4)2Cr2O7 = Cr2O3 + 4H2O↑ + N2↑ Эта реакция относится к группе реакций внутримолекулярного окисления и восстановления. Окислителем является элемент хром, степень окисления которого изменяется от +6 до +3, а восстановителем азот, степень окисления которого изменяется от -3 до +0.
Утилизация отходов: оксид хрома ( III ) собрать в емкость для проведения дальнейших экспериментов.
Вулкан беттгера уравнение реакции сумма коэффициентов
Вулкан Бёттгера
В 1843 г. Рудольф Бёттгер получил дихромат аммония ( NH 4)2 Cr 2 O 7 — оранжево-красное кристаллическое вещество. Он решил испытать это 
Позднее было установлено, что дихромат аммония самопроизвольно разлагается не только от зажженной лучинки или спички, но и от нагретой стеклянной палочки. При этом выделяется газообразный азот N 2, пары воды, твердые частички раскаленного оксида хрома С r 2 O 3 и большое количество теплоты.
Идет внутримолекулярная окислительно-восстановительная реакция:
Железный вулкан Лемери
Французский химик, аптекарь и врач Никола Лемери в 1б73 наблюдал нечто похожее на вулкан, когда, смешав в железной чашке 2 г железа F е в виде опилок и 2 г порошкообразной серы S , дотронулся до смеси сильно нагретой стеклянной палочкой. Буквально через несколько секунд из смеси начали вылетать частицы черного цвета, а сама она сильно увеличившись в объеме, так разогрелась, что начала светиться.
Вулкан Лемери — результат взаимодействия железа и серы:
Эта реакция сопровождается значительным выделением энергии в форме теплоты.
Цинковый вариант
Шведский химик Георг Брандт исследовал свойства цинка и выполнил опыт, похожий на реакцию Лемери. Он смешал тонко из мельченные серу (1 г) и цинк (2 г), а потом прикоснулся к смеси раскаленным железным шпателем. Появились пламя и густой белый дым, содержащий мельчайшие частицы сульфида цинка ZnS :
Ферратный вулкан
Чтобы показать эффектный опыт — извержение ферратного вулкана, смешивают 1 г железного порошка или железной пудры с 2 г сухого нитрата калия К NO 3, предварительно растертого в ступке. Смесь помещают в углубление горки, сделанной из 4—5 столовых ложек сухого просеянного речного песка, смачивают этиловым спиртом или одеколоном и поджигают.
Начинается бурная реакция с выделением искр, буроватым дымом и сильным разогревом — почти полная картина вулканической деятельности!
При взаимодействии нитрата калия с железом образуется феррат( VI ) калия К2 FeO 4 и газообразный монооксид азота NO , который окисляется на воздухе и дает красно-бурый газ — диоксид азота NO 2:
Если твердый остаток после окончания реакции поместить в стакан с холодной кипяченой водой, получится красно-фиолетовый раствор феррата( VI ) калия. При подкислении этого раствора происходит выделение кислорода O2 :
Угольный вулкан
В фарфоровой чашке расплавляют 2—3 г нитрата калия К NO 3 и в расплав бросают кусочек древесного угля. Происходит «извержение вулкана»: уголь начинает ярко гореть, подпрыгивая над расплавом, и может даже вылететь из чашки. Поэтому перед опытом нужно надеть защитные очки, а после начала горения надо отойти от чашки подальше, на расстояние полтора-два метра.
Реакция заканчивается образованием нитрита калия К NO 2 и выделением диоксида углерода СО2.
Этот вулканический опыт будет выглядеть особенно эффектно, если показывать его в сумерках или ночью на открытом воздухе. Показывая этот и другие подобные опыты, позаботьтесь о безопасности зрителей, усадив их подальше. Помните: нельзя наклоняться над вулканом и прикасаться к нему, пока процесс не закончится и все вещества не остынут!
Дымящий вулкан
На дно высокого химического стакана насыпают слой песка толщиной 3—4 см и ставят фарфоровую чашку, в которую из пипетки наливают по 10 мл концентрированной азотной кислоты HNO 3 (плотностью 1,50 г/мл) и концентрированной серной кислоты Н2 SO 4 (плотностью 1,84 г/мл). Стакан с чашкой помещают в вытяжной шкаф и из пипетки приливают по каплям только что перегнанный скипидар. Каждая капля, попадая на поверхность смеси двух кислот, воспламеняется и сгорает с выделением густого черного дыма с большим количеством копоти.
Азотная кислота является окислителем скипидара, а серная кислота действует как обезвоживающее средство, ведь при сгорании скипидара образуются вода и диоксид углерода СО2.
Вулкан Шееле
В 1779 г. шведский аптекарь-химик Карл Шееле впервые получил глицерин и назвал полученную жидкость «сладкое масло». Изучая свойства глицерина, он однажды смешал его с кристаллическим перманганатом калия. Неожиданно произошла вспышка смеси.
Теперь этот эффектный опыт с выбросом огня осуществляют следующим образом. В фарфоровую чашку или на керамическую плитку насыпают в виде горки тщательно растертый в ступке перманганат калия КМ n О4. В вершине горки делают небольшое углубление, вносят ту да несколько капель глицерина С3Н5(ОН)3, не содержащего примеси воды, и сразу же отходят в сторону: сейчас «вулкан» проснется! Через 1—2 минуты происходит вспышка фиолетового цвета из-за разбрызгивания небольшой части КМ n О4; глицерин при этом воспламеняется.
Реакция, вызвавшая вспышку, отвечает уравнению:
и сопровождается большим выделением энергии в форме теплоты и газообразных продуктов (СО2, пары воды), которые увлекают за собой раскаленные твердые частицы диоксида марганца М n О2 и карбоната калия К2 CO 3. Полная иллюзия извержения вулкана!
Ганс Гольдшмидт и вулканический термит
В 1898 г. немецкий инженер-металлург Ганс Гольдшмидт изобрел способ выплавки металлов из их оксидов с помощью алюминия как восстановителя. Смесь порошкообразных алюминия и оксида выплавляемого металла он назвал термитом (от греческого «терме» — жар, теплота). В реакциях с участием оксидов металлов и алюминия развивается температура около 2400 °С, а сама эта окислительно-восстановительная реакция начинается, когда температура смеси достигает 1000 °С. Способ получения металлов с помощью термита назвали алюмотермией, а смесь порошков оксида металла и алюминия — термитом Гольдшмидта.
Попробуем провести получение железа из его оксида Fe 2 O 3 способом Гольдшмидта, который внешне напоминает извержение лавы из кратера вулкана. Для опыта предварительно готовят совершенно сухой речной песок, высушивая его при 200 o С в сушильном шкафу или просто в духовке. Одновременно высушивают небольшой цветочный горшок. Ненужный железный тазик наполняют сухим песком, а над ним укрепляют в кольце штатива глиняный цветочный горшок и закрывают его донное отверстие листом фильтровальной бумаги. Высушенные порошки оксида железа( III ) и алюминия смешивают в соотношении 3:1 по массе. Этой смеси — термита — берут не более 200 г (около 50 г А l и приблизительно 150 г Fe 2 O 3) и засыпают ее в горшок на 3/4 его объема. Для приготовления термитной смеси не следует вместо алюминиевого порошка брать алюминиевую пудру: реакция с ней идет слишком бурно и приводит к разбрызгиванию смеси.
В термитной смеси, засыпанной в горшок, делают по центру углубление и помещают в него запал — обрезок магниевой ленты, зачищенной мелкозернистой наждачной бумагой. С помощью длинной лучинки зажигают магниевую ленту и быстро отходят в сторону на расстояние 2—3 м. После того как сгорает запал, начинается бурная реакция. Над горшком появляется пламя и дым, из него вылетают раскаленные частички оксида железа( III ), а из донного отверстия вытекает струйка расплавленного железа, образовавшегося по реакции:
Алюминий — металл, более активный в химическом отношении, чем железо, поэтому он в полной мере проявляет свою восстановительную способность, отнимая у оксида железа( III ) кислород и превращаясь в оксид алюминия А l . Когда расплавленное железо остынет, извлекают образовавшийся королек из песка и очищают от шлака — оксида алюминия.
Теперь понятно, почему песок должен быть совершенно сухим? Из влажного песка будет испаряться вода, и капли расплавленного железа начнут разбрызгиваться. В этом случае опыт станет крайне опасным.
Цинковый вулкан
Давайте смастерим вулкан из 1,5 г цинковой пыли и 2 мл тетрахлорида углерода СС l 4. Смешаем эти вещества и добавим к смеси 1—2 г оксида магния М gO или такое же количество оксида цинка ZnO , чтобы Получить густую массу. Затем на листе железа или в старой миске сделаем из этой массы горку. Дальнейшие операции надо выполнять в вытяжном шкафу либо на открытом воздухе. Разместим железный лист или миску со смесью на двух кирпичах, между которыми разведем небольшой костер. Ясно, что в лаборатории вместо костра можно будет взять спиртовку. Все это будет необходимо, чтобы разогреть смесь до 150— 200 о С. Как только такая температура достигнута, начинается бурная реакция. Из смеси то появляется, то исчезает пламя, выделяется густой черный дым. Вот вам и вулкан в момент извержения!
Тетрахлорид углерода и цинк реагируют с образованием хлорида цинка ZnCl 2 и углерода (сажи):
С Cl 4 + 2 Zn = 2 ZnCl 2 ↓ + C
Хлорид цинка легко испаряется, а на холоду конденсируется в твердые частицы, жадно поглощающие из воздуха влагу.
Йодный вулкан
Для этого опыта смешиваем 10 г йода, мелко истертого в фарфоровой ступке, с 2,5 г цинковой пыли. Смесь высыпаем горкой в старую тарелку или на керамическую плитку. В вершине горки выдавливаем сухим дном небольшой пробирки углубление, в которое вносим 2—3 капли разбавленной соляной кислоты и сразу накрываем стеклянным колоколом или большой стеклянной банкой. Через 1—2 минуты начинается бурная реакция. Горка воспламеняется, выделяются фиолетовые пары йода, из которых на холодных стенках банки или на поверхности кол кола образуются мельчайшие кристаллики.
Цинк реагирует с йодом и дает иодид цинка ZnI 2:
Выделяющаяся при этом теплота нагревает смесь и способствует возгонке йода, а соляная кислота служит инициатором этой реакции.
Искристый вулкан
Этот опыт требует большой подготовки, он порадует тех, кто не боится подобной работы. Вначале готовят бумажную гильзу или патрон. Из листа бумаги вырезают прямоугольник шириной 4 см и длинной 10 см. Его наворачивают на обрезок круглой деревянной палки диаметром 6—8 мм и длиной 12—13 см, смазав бумажную заготовку клейстером с внутренней стороны на ширину 3—4 см. Последний оборот бумаги также смазывают клейстером и плотно прижимают к деревянной вставке. Затем вставку выдвигают на 1 см и освобождают гильзу на ее конце. Этот конец с двух противоположных сторон сгибают, чтобы получилось донышко, смазывают клейстером и придавливают деревянной вставкой к плоской поверхности. Полученную таким образом гильзу снимают со вставки и сушат. После этого готовят смесь из 8 г тщательно растертого в фарфоровой ступке нитрата калия К NO 3 и 2 г мелкозернистого древесного угля, которую и насыпают в гильзу, слегка утрамбовывая деревянной вставкой. Когда гильза будет почти заполнена, вставляют конец фитиля и досыпают смесь. Выступающий конец фитиля дол жен иметь длину 3—4 см.
Фитиль — это слабо скрученная льняная веревка или шнур толщиной 3—5 мм, вываренная в водном растворе ацетата свинца в течение 5—10 минут. Раствор должен содержать на каждые 10 г соли 20 мл воды. Пропитанную солью свинца веревку сушат, а потом протирают суконкой для удаления ворса, который мог бы увеличить скорость горения фитиля. Она должна быть около 25 см/ч.
Теперь все готово, пора привести «вулкан» в действие. Гильзу закапывают в сухой песок, помещенный в железное ведро или железную банку, оставляя 1/4 высоты гильзы над песком, и поджигают фитиль, а потом отходят от вулкана на расстояние 2—3 м. Фитиль воспламеняет смесь, и из гильзы начинает вылетать сноп мелких искр с дымом, вырывается розоватое пламя. Вулкан действует 2—3 минуты, а потом извержение прекращается.
Горение смеси ведет к образованию К2СО3, монооксида углерода и азота:
Если в смесь добавить щепотку нитрата бария Ва( N О3)2 то пламя приобретет зеленый цвет.
Фиолетовый джинн
Йод реагирует с химически активными металлами (магнием и алюминием) с эффектной вспышкой. При этом выделяются фиолетовые пары, и вся картина напоминает явление джинна из запечатанного сосуда или из лампы Аладдина.
Чтобы показать этот фокус, надо приготовить стеклянный колокол или пятилитровую стеклянную банку либо выполнять опыт на свежем воздухе. В небольшой фарфоровой чашке смешивают половину чайной ложки алюминиевой пудры и чайную ложку предварительно растертого в ступке сухого йода. Учтите, что с порошкообразным алюминием этот опыт не получается! Смесь собирают горкой и в вершине ее делают углубление, в которое приливают из пипетки 2—3 капли дистиллированной воды. Сразу же накрывают чашку со смесью стеклянным колоколом или банкой.
Через несколько секунд над горкой появляется маленькое фиолетовое облачко, а это означает, что джинн проснулся. Потом происходит внезапная вспышка с образованием фиолетового пламени и весь коло кол наполняется фиолетовым дымом.
В результате реакции образуется йодид алюминия А lI 3, а фиолетовая окраска пламени и дыма вызвана частичной возгонкой йода.
Огнедышащая сера
Обыкновенная сера в количестве всего 3 г поможет показать «пасть огнедышащего дракона». Для этого надо взять 6 г порошка цинка или 2 г алюминиевой пудры, смешать порошок металла с 3 г серного цвета (пылевидной серы), а потом сделать из смеси горку и поджечь ее длинной лучинкой.
Мгновенно происходит сильнейшая вспышка с образованием белого облака дыма, состоящего из мельчайших частичек А l 2 S 3 или ZnS .
И еще гейзеры
В вулканической местности нередко встречаются гейзеры. Это фонтаны горячей воды и грязи, смешанной с водяным паром.
Маленький искусственный гейзер на столе получится, если на электрическую плитку положить медную или железную пластинку, а на нее поместить несколько крупных темно-фиолетовых кристаллов хромокалиевых квасцов KCr ( SO 4)2∙12 H 2 O – додекагидрата сульфата хрома( III )-калия. Вскоре после включения плитки поверхность кристаллов становится матовой, потом они, не теряя формы, плавятся, растворяясь в собственной кристаллизационной воде — ведь на 1 моль соли приходится целых 12 моль воды.
С ростом температуры металлической, пластинки, на которой лежат кристаллы, пленка расплава на их поверхности начинает лопаться из-за выделения паров воды. Сквозь образующиеся трещины показываются серые пузыри, похожие на грязевые пузыри в гейзерах. При более высокой температуре хромокалиевые квасцы полностью обезвоживаются и превращаются в зеленый порошок оксида хрома( III ) Cr 2 O 3, смешанный с бесцветным сульфатом калия.
В реакции термического разложения хромокалиевых квасцов еще образуется серная кислота Н2 SO 4, улетучивающаяся вместе с парами воды:
Вулкан Бёттгера — химический опыт
Одним из ярчайших и наглядных показательных химических опытов является вулкан, который придумал Рудольф Бёттгер, открывший бихромат аммония в середине 19 века. Опыт можно использовать как пример окислительно-восстановительной реакции.
Также, Рудольф Бёттгер, стал знаменит как изобретатель спичек, первым предложив наносить на деревянные лучинки воспламеняющуюся смесью.
После получения данного вещества Бёттгер решил испытать его. Вещество не детонировало от ударов по веществу кувалдой, после чего Рудольф решил проверить вещество на горение.
Для проведения опыта «химический вулкан» необходима огнеупорная плитка, например кафельная, гранитная или лабораторная из асбеста, на которую насыпают горкой небольшое количество измельченного в фарфоровой ступке, до порошкообразного состояния бихромата аммония. Сверху горки делают маленькую воронку, похожее на жерло для нашего вулкана, куда приливают 1-2 мл этанола и поджигают.
Спирт возгорается, дихромат аммония начинает разлагаться с выделением энергии. В ходе реакции получается азот, вода (в парообразном состоянии , в связи с достаточно высокой температурой протекания реакции) и оксид трехвалентного хрома.
(NH4)2Cr2O7 → N2↑ + 4H2O↑ + Cr2O3
Из вулкана начинают вырываться яркие оранжевые искры, с обильным образованием серо-зеленого «вулканического пепла», оксида хрома (III).
http://interestingchem.narod.ru/zanopyt/4.htm
http://in-chemistry.ru/himicheskiy-vulkan-rudolfa-byottgera