органической и неорганической химии
I вариант
Задание №1
Отметьте схемы реакций присоединения:
Выберите несколько из 4 вариантов ответа:
1) CH3 — CH2OH → CH2 = CH2 + H2O
2) nC6H12O6 → (C6H10O5)n + n H2O
3) n(CH2 = CHCl) → (-CH2 — CH -)n
|
Cl
4) CH3 — CH = CH2 + Br2 → CH3 — СHBr — CH2Br
Задание №2
Укажите схемы реакций соединения:
Выберите несколько из 4 вариантов ответа:
1) AgNO3 → Ag + NO2 + O2
2) Fe(OH)3 → Fe2O3 + H2O
3) SO2 + O2 → SO3
4) NO2 + O2 + H2O → HNO3
Задание №3
Отметьте уравнения или схемы окислительно-восстановительных реакций:
Выберите несколько из 4 вариантов ответа:
1) Al + Cl2 → AlCl3
2) H2O2 → H2O + O2
3) Cu + AgNO3 → Cu(NO3)2 + Ag
4) BaCO3 = BaO + CO2
Задание №4
Выберите уравнения или схемы гетерогенных реакций:
1) Na2CO3 (т) + 2HCl (ж) = 2NaCl (р) + H2O (ж) + CO2 (г)
2) KOH (р-р) + HNO3 (р-р) = KNO3 (р-р) + H2O (ж)
3) FeS2 (т) + O2 (г) → Fe2O3 (т) + SO2 (г)
4) CaO (т) + CO2 (г) = CaCO3 (т)
Задание №5
Какие из перечисленных реакций являются окислительно-восстановительными?
1) взаимодействие водных растворов сульфата натрия и хлорида бария
2) обжиг известняка
3) фотосинтез
4) обжиг пирита
Задание №6
Для реакции верными являются утверждения:
кат.
N2 + 3H2 2NH3 + Q
Выберите несколько из 4 вариантов ответа:
1) является каталитической реакцией
2) является эндотермической реакцией
3) является обратимой реакцией
4) является реакцией разложения
Задание №7
Укажите реакции замещения:
Выберите несколько из 4 вариантов ответа:
1) серная кислота + оксид цинка
2) магний + соляная кислота
3) гидроксид калия + фосфорная кислота
4) нитрат серебра + цинк
Классификация химических реакций
в органической и неорганической химии
II вариант
Задание №1
Отметьте уравнения или схемы экзотермических реакций:
1) C + O2 = CO2 + 369 кДж
2) N2 + H2 → NH3 + Q
3) SO2 + O2 — Q → SO3
4) CaCO3 = CaO + CO2 -152 кДж
Задание №2
Для описания реакции обжига пирита подходят определения:
1) гомогенная
2) гетерогенная
3) окислительно-восстановительная
4) разложения
Задание №3
Укажите уравнения или схемы необратимых реакций:
1) Ba(OH)2 + H2SO4 = BaSO4↓ + 2H2O
2) N2 + 3H2 2NH3
3) NaOH + HCl = NaCl + H2O
4) SO2 + O2 SO3
Задание №4
Укажите схемы реакций, для проведения которых используется катализатор:
1) KOH + H2SO4 → K2SO4 + H2O
2) NH3 + O2 → NO + H2O
3) N2 + H2 → NH3
4) NH3 + O2 → N2 + H2O
Задание №5
Укажите схемы реакций отщепления:
1) n(H2N — (CH2)5 — COOH) → (-HN — (CH2)5 — C -)n + n H2O
||
O
2) C2H6 + Cl2 → C2H5Cl + HCl
3) CH3 — CH2 — CH2OH → CH3 — CH = CH2 + H2O
4) C6H5 — СHBr — CH3 → C6H5 — CH = CH2 + HBr
Задание №6
Реакция взаимодействия цинка с соляной кислотой относится к реакциям:
Выберите один из 4 вариантов ответа:
1) замещения
2) соединения
3) обмена
4) разложения
Задание №7
Какие характеристики верны для реакции получения оксида серы (VI) из оксида серы (IV):
Выберите несколько из 4 вариантов ответа:
1) каталитическая
2) обмена
3) необратимая
4) окислительно-восстановительная
Тест по теме «Классификация химических реакций в неорганической химии»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Классификация химических реакций
в неорганической химии
Отметьте уравнения или схемы экзотермических реакций:
Укажите схемы реакций соединения:
Выберите несколько из 4 вариантов ответа:
Отметьте уравнения или схемы окислительно-восстановительных реакций. Укажите восстановитель,окислитель
Выберите несколько из 4 вариантов ответа:
Выберите уравнения или схемы гетерогенных реакций. Выберите реакции ионного обмена. Запишите их в ионном виде.
1) Na2CO3 ( т ) + 2HCl ( ж ) = 2NaCl ( р ) + H2O ( ж ) + CO2 ( г )
2) KOH ( р — р ) + HNO3 ( р — р ) = KNO3 ( р — р ) + H2O ( ж )
4) CaO ( т ) + CO2 ( г ) = CaCO3 ( т )
Какие из перечисленных реакций являются окислительно-восстановительными? Напишите эти уравнения реакций.
1) взаимодействие водных растворов сульфата натрия и хлорида бария
2) обжиг известняка
Для реакции верными являются утверждения:
Выберите несколько из 4 вариантов ответа:
1) является каталитической реакцией
2) является эндотермической реакцией
3) является обратимой реакцией
4) является реакцией разложения
Укажите реакции замещения: Напишите уравнения реакции
Выберите несколько из 4 вариантов ответа:
1) серная кислота + оксид цинка
2) магний + соляная кислота
3) гидроксид калия + фосфорная кислота
4) нитрат серебра + цинк
Отметьте уравнения или схемы реакции разложения.
Для описания реакции обжига пирита подходят определения. Напишите уравнение реакции
Укажите уравнения или схемы необратимых реакций(1 и 3реакции запишите в ионном виде)
3) NaOH + HCl = NaCl + H2O
Укажите схемы реакций, для проведения которых используется катализатор.(3 реакцию запишите как окислительно – восстановительный процесс)
Реакция взаимодействия цинка с соляной кислотой относится к реакциям. Напишите данную реакцию
Выберите один из 4 вариантов ответа:
Какие характеристики верны для реакции получения оксида серы ( VI ) из оксида серы ( IV ):Напишите данную реакцию.
Выберите несколько из 4 вариантов ответа:
Задача №1. Найдите массу осадка, который образовался при взаимодействии 160гр. 15%раствора гидроксида кальция с фосфорной кислотой.
Задача №2. Найдите массу осадка, который образовался при взаимодействии 70гр. 9%раствора хлорида бария с сульфатом алюминия.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 925 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 35 человек из 23 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 24 человека из 14 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 578 555 материалов в базе
Материал подходит для УМК
«Химия. Базовый уровень», Габриелян О.С.
§ 14. Классификация химических реакций, протекающих с изменением состава веществ
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Другие материалы
- 18.10.2021
- 339
- 20
- 18.10.2021
- 192
- 4
- 18.10.2021
- 237
- 8
- 18.10.2021
- 109
- 0
- 18.10.2021
- 115
- 1
- 18.10.2021
- 210
- 1
- 18.10.2021
- 170
- 0
- 18.10.2021
- 164
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 18.10.2021 763
- DOCX 15.9 кбайт
- 14 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Русинова Галина Васильевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 6 лет и 7 месяцев
- Подписчики: 0
- Всего просмотров: 23097
- Всего материалов: 13
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Онлайн-конференция о создании школьных служб примирения
Время чтения: 3 минуты
Полный перевод школ на дистанционное обучение не планируется
Время чтения: 1 минута
Приемная кампания в вузах начнется 20 июня
Время чтения: 1 минута
Минпросвещения подключит студотряды к обновлению школьной инфраструктуры
Время чтения: 1 минута
ЕГЭ в 2022 году будут сдавать почти 737 тыс. человек
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
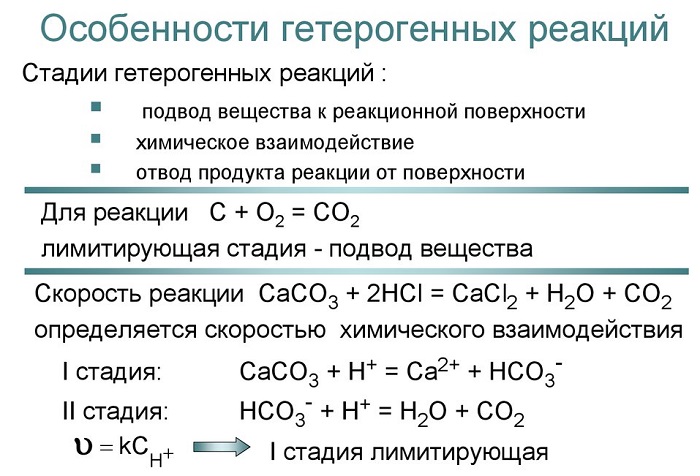
Гетерогенные реакции — формулы, особенности протекания и примеры задач
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
Термическое разложение солей на газообразные и твердые продукты — типичный пример гетерогенной реакции:
СаСО3 -> СаО + СО2,
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Zn + H2SO4 -> ZnSO4 + Н2.
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
- Твердое тело– газ. Сжигания угля иллюстрирует реакцию газа и твердого вещества: твердый углерод взаимодействует с газообразным кислородом, при этом получается углекислый газ;
- Несмешивающиеся жидкости. При взаимодействии толуола и азотной кислоты, а это несмешивающиеся жидкости, происходит гетерогенная реакция 2 типа;
- Газ – жидкость. Примером можно назвать процесс орошения, когда диспергированная в виде капель жидкость пролетает через газ;
- Жидкость – твердое вещество. Серная кислота и оксид цинка – пример реакции между жидкостью и твердой фазой.
Скорость гетерогенной реакции и влияющие на нее факторы
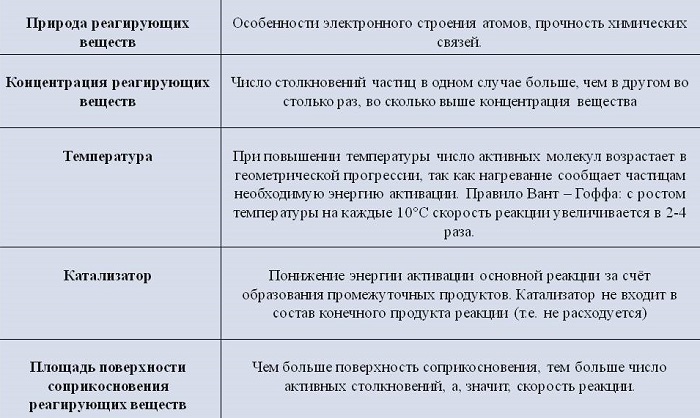
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
http://infourok.ru/test-po-teme-klassifikaciya-himicheskih-reakcij-v-neorganicheskoj-himii-5394316.html
http://nauka.club/khimiya/geterogennye-reaktsii.html