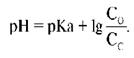Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство — концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая — двухметаллической солью фосфорной кислоты.
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Примером кислотного буфера может служить ацетатный буферный раствор, содержащий смесь уксусной кислоты и ацетата натрия (СНзСООН + СНзСООNа). При добавлении к такому раствору кислоты она взаимодействует с солью и вытесняет эквивалентное количество слабой кислоты: СНзСООNа + НСl ó СН3СООН + NaСl. В растворе вместо сильной кислоты образуется слабая, и поэтому величина рН уменьшается незначительно. Если к этому буферному раствору добавить щелочь, она нейтрализуется слабой кислотой, и в растворе образуется эквивалентное количество соли: СНзСООН + NaОН ó СНзСООNа + Н2О. В результате рН почти не увеличивается. Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: СНзСООNа -> Na + + СН3СОО
СНзСОО — + НОН ó СНзСООН + ОН — . Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: СНзСООН ó СН3СОО+H — Слабая диссоциация СНзСООН еще более подавляется в при-сутствии СНзСООNа, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:[СНзСООН] = сr. C другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СНзСОО] = сс. Это уравнение называют уравнением буферного раствора (уравнением Гендерсона Гассельбаха). Его анализ для буферного раствора, образованного слабой кислотой и ее солью, показывает, что концентрация водородных ионов в буферном растворе определяется константой диссоциации слабой кислоты и соотношением концентраций кислоты и соли. Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В — буферная емкость; с — концентрация сильной кислоты или основания (моль/л); V — объем добавленного сильного электролита (л); Vб — объем буферного раствора (л); д рН — изменение рН.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
Буферные растворы
Буферные растворы — это растворы, величина рН которых мало изменяется при добавлении к ним небольших количеств сильных кислот или щелочей, а также при разбавлении.
C точки зрения протонной теории простейший буферный раствор состоит из слабой кислоты и сопряженного ей основания или слабого основания и его сопряженной кислоты. В этом случае буферное действие растворов характеризуется наличием кислотно-основного равновесия:
Образуемые сопряженные кислотно-основные пары НА/А– и В/ВН+ называют буферными системами.
Классификация буферных систем
1. Кислотные. Состоят из слабой кислоты и соли этой кислоты. Например, ацетатная буферная система (CH3COOH+ СН3СООNa ), гидрокарбонатная буферная система (H2CO3 +NaHCO3 ).
2. Основные. Состоят из слабого основания и его соли. Например, аммиачная буферная система (NH3⋅H2O + NH4Cl).
3. Солевые. Состоят из кислой и средней соли или двух кислых солей. Например, карбонатная буферная система (NaHCO3+Na2CO3 ), фосфатная буферная система (КН2PO4 + К2НPO4).
4. Аминокислотные и белковые. Если суммарный заряд молекулы аминокислоты или белка равен нулю (изоэлектрическое состояние), то растворы этих соединений не являются буферными. Их буферное действие начинает проявляться тогда, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из изоэлектрического состояния в форму “белок-кислота” или соответственно в форму “белок-основание”. Образуется смесь двух форм белка: а) слабая “белок-кислота” + соль этой слабой кислоты; б) слабое “белок — основание” + соль этого слабого основания:

Расчет рН буферных систем
Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга.
Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты:
CH3COONa → Na+ + CH3COO–
CH3COO– + HOH ⇄ CH3COOH + OH–
Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени:
CH3COOН ⇄CH3COO– + H+
Слабая диссоциация СН3СООН еще более подавляется в присутствии СН3СООNa, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:
С другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты:
Согласно закону действующих масс, равновесие между продуктами диссоциации уксусной кислоты и недиссоциированными молекулами подчиняется уравнению:
Кд = 
Подставив общую концентрацию кислоты и соли в уравнение константы диссоциации, получим: [Н+] = Кд
отсюда для кислотных буферных систем: рН = рК(кислоты) + lg 
рК — отрицательный десятичный логарифм константы диссоциации
После аналогичного вывода для основных буферных систем:
рОН = рК(основания) + lg 
где рК(кислоты),рК(основания) — отрицательный десятичный логарифм константы электролитической диссоциации слабой кислоты; слабого основания; [соль] — концентрация соли, [кислота] — концентрация кислоты, [основание] — концентрация основания.
Из этих уравнений видно, что рН кислотной (основной) буферной системы зависит от природы слабого электролита (рК(кислоты), рК(основания)) и от соотношения концентраций соли и кислоты (основания).
Следует отметить, что буферные системы эффективно поддерживают рН в диапазоне: рК(кислоты)± 1 для кислотных систем; 14 – (рК(основания)± 1) для основных систем.
Механизм действия буферных систем:
1. Разбавление. При разбавлении водой происходит уменьшение концентрации обоих компонентов в буферной системе в одинаковой степени, поэтому величина их соотношения не изменится. рК(кислоты) и рК(основания) являются постоянными при данной температуре и не зависят от разбавления. Действительно, одновременное понижение концентраций кислоты и соли в ацетатной буферной системе от 0,1М до 0,001М при разбавлении водой изменяет рН буферного раствора с 4,63 до 4,73 (это ничтожное изменение рН при разбавлении буферного раствора в 100 раз обусловлено некоторым изменением коэффициента активности соли). Следовательно, разбавление в конечном итоге мало изменяет рН буферных систем.
2. Добавление кислот и оснований. При добавлении небольших количеств сильных кислот или оснований рН буферных систем изменяется незначительно. Например, рассмотрим ацетатный буфер:
кислотный компонент – основной компонент–
слабая кислота сопряженное основание
а) При добавлении к ацетатному буферу небольшого количества HCl, происходит взаимодействие ионов Н+ с основным компонентом буферного раствора:
Н+ + СН3СОО–⇄ СН3СООН.
Степень диссоциации СН3СООН мала и концентрация [H+] практически не меняется. рН буферного раствора уменьшится, но незначительно.
Таким образом, если к ацетатному буферу добавить Х моль/л HCl, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
б) При добавлении небольшого количества NaOH, 

В результате этого, добавленное сильное основание заменяется эквивалентным количеством слабого сопряженного основания (СН3СОО–), которое в меньшей степени влияет на реакцию cреды. рН буферного раствора увеличивается, но незначительно.
Таким образом, если к ацетатному буферу добавить У моль/л NaOH, то уравнение для расчета рН буферной системы принимает вид:
рН = рК(кислоты) + lg
Способность буферного раствора сохранять значение рН при добавлении сильной кислоты или щелочи приблизительно на постоянном уровне характеризует буферная емкость.
Буферная емкость (В) — это число молей эквивалента сильной кислоты или щелочи, которое необходимо добавить к 1 л буферного раствора, чтобы сместить его рН на единицу.
Буферная емкость системы определяется по отношению к добавляемым кислоте (Вкисл.) или основанию (щелочи) (Восн.) и рассчитывается по формулам:
Вкисл.= 
где V(HA), V(B) — объемы добавленных кислоты или щелочи, л.; Сн(НА), Сн(В) — молярные концентрации эквивалента соответственно кислоты и щелочи; V(б. р.) — объем исходного буферного раствора, л.; рНо, рН — значения рН буферного раствора до и после добавления кислоты или щелочи; |рН-рНо| — разность рН по модулю.
Буферная емкость по отношению к кислоте (Вкисл.) определяется концентрацией (количеством эквивалентов) компонента с основными свойствами; буферная емкость по отношению к основанию (Восн.) определяется концентрацией (количеством эквивалентов) компонента с кислотными свойствами в буферном растворе.
Максимальная буферная емкость при добавлении сильных кислот и оснований достигается при соотношении компонентов буферного раствора равном единице, когда рН = рК, при этом Восн.= В кисл. (рис.1).Поэтому, применение любой буферной смеси ограничено определенной областью рН (областью буферирования), а именно:
рН = рК(кислоты)± 1 для кислотных систем, или
рН= 14 – (рК(основания)± 1) для основных систем.
Буферная емкость зависит не только от отношения концентраций компонентов буферного раствора, но и от общей концентрации буферной смеси.
Рис.1. Изменение буферной емкости в зависимости от величины отношения [соль]/[кислота].
Пусть, например, даны два буферных раствора, один из которых содержит по 100, а другой – по 10 миллимолей уксусной кислоты и ацетата натрия. Сравним, как изменяются их рН при добавлении к 1 л каждого раствора 5 миллимолей соляной кислоты.
Добавляемая кислота вступит в реакцию с ацетатом натрия, и это отношение в первом растворе станет равным 0,9, а во втором 0,33. В итоге у первого раствора отношение соль/кислота и, следовательно, величина рН изменились меньше. Отсюда видно, что первый буферный раствор обладает большей буферной емкостью.
Таким образом, буферная емкость в основном зависит от соотношения концентраций компонентов и их абсолютных концентраций, а следовательно, от разбавления.
Буферные системы организма
Главным источником ионов водорода в организме является углекислый газ, образующийся в результате метаболизма (обмена веществ) ≈ 15000 ммоль/сутки.
Гидратация углекислого газа приводит к образованию угольной кислоты:
СО2 + Н2О ⇄ Н2СО3⇄ 
В меньшей степени количество ионов Н+ (30–80 ммоль/сутки) обусловлено поступлением в организм, а также образованием в нем таких кислот как серной (в результате обмена серусодержащих аминокислот), фосфорной (при метаболизме фосфорсодержащих соединений), органических кислот, образующихся при неполном окислении липидов и углеводов.
Организм освобождается от кислот благодаря процессам дыхания и мочевыделения, т. е. в организме существует взаимосвязь между метаболическими процессами и газообменом. В оценке кислотно-основного состояния организма важно не только определение значения рН, но и характеристика механизмов, обеспечивающих регуляцию этого параметра.
Если бы в организме не было немедленных буферных механизмов и респираторной (дыхательной) компенсации, то тогда даже обычные, ежедневные нагрузки кислотами сопровождались бы значительными колебаниями величины рН.
Постоянство рН жидких сред организма поддерживается в живых организмах буферными системами. Главным из них являются гидрокарбонатная, гемоглобиновая, фосфатная и белковая. Действие всех буферных систем в организме взаимосвязано, что обеспечивает биологическим жидкостям постоянное значение рН. В организме человека и животных буферные системы находятся в крови (плазме и эритроцитах), в клетках и межклеточных пространствах других тканей.
Буферные системы крови представлены буферными системами плазмы крови и буферными системами эритроцитов. Буферные системы плазмы – гидрокарбонатная, белковая и фосфатная, роль последней незначительна. На их долю приходится ≈ 44% буферной емкости крови. Буферные системы эритроцитов – гемоглобиновая, гидрокарбонатная, система органических фосфатов (фосфатная). На их долю приходится ≈ 56% буферной емкости крови.
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха
Буферные системы
буферные системы образованы буферными растворами
буферные – растворы, рН которых почти не меняется
при разбавлении или добавлении небольших количеств к-ты или основания
ПР: ацетатный СН3СООН + СН3СООNa
согласно протонной теории буферные системы — сопряженные кислотно-основные пары B/BH + и НА/А —

основание сопряженная к-та к-та сопряженное основание
в живых организмах буферные системы поддерживают кислотно-основный гомеостаз
кислотно-основный гомеостаз — кислотно-основное равновесие внутренней среды организма
рН внутренней среды организма должен быть оптимальным для биохимических реакций
для человека физиологическое значение pH=7,4
кислотно-основное равновесие поддерживают буферные свойства крови и механизмы коррекции
62)Классификация буферных систем.
буферные системы различают по компонентам:
— слабая кислота и ее соль, образованная сильным основанием – буферная система кислотного типа
ПР: ацетатный буфер СН3СООН + СН3СООNa
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: ацетатный буфер СН3СООН/СН3СОО —
— слабое основание и его соль, образованная сильной кислотой – буферная система основного типа
ПР: аммиачный буфер NН4ОН + NH4Cl
по теории Берстреда буферная система основного типа — сопряженная кислотно-основная пара B/BH +
— соли слабых многоосновных кислот – буферная система кислотного типа
по теории Берстреда буферная система кислотного типа — сопряженная кислотно-основная пара НА/А —
ПР: фосфатный буфер H2PO — /HPO4 2-
— амфолиты – буферная система кислотного типа
ПР: аминокислотный буфер
63)Механизм действия ацетатного буфера.
ацетатный буфер состоит из уксусной кислоты СН3СООН и ацетата натрия СН3СООNa
— уксусная кислота – слабый электролит
 | |
 |  |
где Ка=1,85×10 -5 — коэффициент диссоциации уксусной кислоты
— ацетат натрия – сильный электролит
ацетат натрия увеличивает концентрацию аниона СН3СОО —
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево
диссоциация уксусной кислоты тормозится
практически, анион СН3СОО — образуется только путем диссоциации ацетата натрия СН3СООNa
молярная концентрация аниона СН3СОО — равна молярной концентрации соли [СН3СОО — ]=[СН3СООNa]

 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности уксусной кислоты
— при разбавлении ацетатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН ацетатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и ацетата натрия
СН3СОО — + Na + + H + + Cl — ® СН3СООH + Na + + Cl —
катионы водорода H + связываются анионами уксусной кислоты СН3СОО — + H + ® СН3СООH
рН ацетатного буфера изменится за счет увеличения концентрации уксусной кислоты и уменьшения соли
механизм изменения рН:
*хотя образуется избыток уксусной кислоты СН3СООH и равновесие реакции СН3СООН Û СН3СОО — + Н + смещается вправо,
но по закону Освальда повышение концентрации СН3СООH снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН ацетатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и уксусной кислоты
СН3СООH + Na + + ОН — ® СН3СОО — + Na + + Н2О
гидроксид-ионы ОH — связываются катионами водорода уксусной кислоты ОН — + H + ® Н2О
рН ацетатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона уксусной кислоты СН3СОО — и
равновесие реакции СН3СООН Û СН3СОО — + Н + смещается влево,
но по закону Освальда снижение концентрации СН3СООH повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя уксусная кислота расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН ацетатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН ацетатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН ацетатного буфера значительно
Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха.
фосфатный буфер состоит из солей ортофосфорной кислоты: однозамещенной NaH2PO4 и двузамещенной Na2HPO4
— соли ортофосфорной кислоты – сильные электролиты
Na2HPO4® NaHPO4 — + Na + NaHPO4 — ® HPO4 2- + Na + HPO4 2- Û PO4 3- + Н + (эта стадия практически, не идет)
важно, что H2PO4 — — слабая кислота и слабый электролит, NaHPO4 — — сильный электролит



где Ка — коэффициент диссоциации кислоты H2PO4 —
— NaHPO4 — — сильный электролит
NaHPO4 — увеличивает концентрацию аниона HPO4 2-
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево
диссоциация H2PO4 — тормозится
практически, анион HPO4 2- образуется только путем диссоциации NaHPO4 —
молярная концентрация аниона HPO4 2- равна молярной концентрации соли [HPO4 2- ]=[NaHPO4 — ]
— рН фосфатного буфера определяет Ка и соотношение концентрации H2PO4 — и NaHPO4 —
 |
 |
 |
 |
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности кислоты H2PO4 —
— при разбавлении фосфатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН фосфатного буфера сохранится
— при добавлении кислоты идет реакция кислоты и NaHPO4 —
HPO4 2- + Na + + H + + Cl — ® H2PO4 — + Na + + Cl —
катионы водорода H + связываются анионами HPO4 2- + H + ® H2PO4 —
рН фосфатного буфера изменится за счет увеличения концентрации H2PO4 — и уменьшения HPO4 2-
механизм изменения рН:
*хотя образуется избыток H2PO4 — и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается вправо,
но по закону Освальда повышение концентрации H2PO4 — снижает степень ее диссоциации,
и концентрация катионов водорода H + увеличивается незначительно,
поэтому при добавлении кислоты рН фосфатного буфера, практически, не изменится
— при добавлении основания идет реакция основания и H2PO4 —
гидроксид-ионы ОH — связываются катионами водорода ОН — + H + ® Н2О
рН фосфатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации кислоты
механизм изменения рН:
*хотя образуется избыток аниона HPO4 2- и
равновесие реакции H2PO4 — Û HPO4 2- + Н + смещается влево,
но по закону Освальда снижение концентрации HPO4 2- повышает степень ее диссоциации,
и концентрация катионов водорода H + уменьшается незначительно,
*хотя HPO4 2- расходуется,
но диссоциируют на катионы водорода H + только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН фосфатного буфера, практически, не изменится
— при добавлении небольших количеств кислот-щелочей изменение рН фосфатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН фосфатного буфера значительно
http://pandia.ru/text/80/586/88844.php
http://megaobuchalka.ru/1/4818.html