Правила составления окислительно-восстановительных реакций
Окислительно-восстановительные свойства пероксида водорода
Потренироваться составлять реакции онлайн можно тут .
H2O2 — голубоватая жидкость со слабыми кислотными свойствами.
Пероксид водорода может принимать как окислительные, так и восстановительные свойства, но окислительные свойства сильнее. В окислительно-восстановительных реакциях необходимо сравнивать чьи окислительные свойства сильнее, чтобы правильно написать продукты реакции. В следующей таблице приведены примеры соединений с более сильными и более слабыми окислительными свойствами и примеры соответствующих реакций.
1. H2O2 — окислитель (восстанавливается с образованием H2O) в реакциях со следующими соединениями:
KI (йодиды), KNO2 (нитриты), PbS (сульфиды), Na2SO3 (сульфиты), NH3, соединения Cr +3 .
Примеры реакций:
2KI + H2O2 → I2 + 2KOH
KNO2 + H2O2 → KNO3 + H2O
Na2S + 4H2O2 → Na2SO4 + 4H2O
PbS + 4H2O2 → PbSO4 + 4H2O
Na2SO3 + H2O2 → Na2SO4 + H2O
2NH3 + 3H2O2  → N2 + 6H2O
Соединения Cr +3 в щелочной среде:
Cr2O3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 5H2O
Cr2(SO4)3 + 3H2O2 + 10NaOH → 2Na2CrO4 + 3Na2SO4 + 8H2O
2Cr(OH)3 + 3H2O2 + 4NaOH → 2Na2CrO4 + 8H2O
2NaCrO2 + 3H2O2 + 2NaOH → 2Na2CrO4 + 4H2O
2K3[Cr(OH)6] + 3H2O2 → 2K2CrO4 + 2KOH + 8H2O
2. H2O2 — восстановитель (окисляется с образованием O2) в реакциях со следующими соединениями:
KMnO4, K2Cr2O7, Cl2 (галогены), соединения Au +3 , KNO3 (нитраты), KClO3 (хлораты).
Примеры реакций:
5H2O2 + KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 5O2 + 8H2O
3H2O2 + K2Cr2O7 + 4H2SO4 → Cr2(SO4)3 + 3O2 + K2SO4 + 7H2O
H2O2 + Br2 + 2KOH → 2NaBr + O2 + 2H2O
H2O2 + Cl2 → O2 + 2HCl
3H2O2 + KClO3 → KCl + 3O2 + 3H2O
3H2O2 + 2KNO3 + H2SO4 → K2SO4 + 2NO + 3O2 + 4H2O.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2f0c1de83e5977 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Выбрать уравнение окислительно восстановительной реакции h2o2
18.5. ОВР пероксида водорода
В молекулах пероксида водорода H2O2 атомы кислорода находятся в степени окисления –I. Это промежуточная и не самая устойчивая степень окисления атомов этого элемента, поэтому пероксид водорода проявляет и окислительные, и восстановительные свойства.
Окислительно-восстановительная активность этого вещества зависит от концентрации. В обычно используемых растворах с массовой долей 20 % пероксид водорода довольно сильный окислитель, в разбавленных растворах его окислительная активность снижается. Восстановительные свойства для пероксида водорода менее характерны, чем окислительные, и также зависят от концентрации.
Пероксид водорода – очень слабая кислота (см. приложение 13), поэтому в сильнощелочных растворах его молекулы превращаются гидропероксид-ионы.
В зависимости от реакции среды и от того, окислителем или восстановителем является пероксид водорода в данной реакции, продукты окислительно-восстановительного взаимодействия будут разными. Уравнения полуреакций для всех этих случаев приведены в таблице 1.
Уравнения окислительно-восстановительных полуреакций H2O2 в растворах
Реакция среды
H2O2 окислитель
H2O2 восстановитель
 + 2e – = 4H2O
+ 2e – = 4H2O


 + H2O + 2e – = 3OH
+ H2O + 2e – = 3OH 
 + OH
+ OH  – 2e – = O2 + H2O
– 2e – = O2 + H2OРассмотрим примеры ОВР с участием пероксида водорода.
Пример 1. Составьте уравнение реакции, протекающей при добавлении раствора йодида калия к раствору пероксида водорода, подкисленному серной кислотой.
| 1 | H2O2 + 2H3O  + 2e – = 4H2O + 2e – = 4H2O |
| 1 | 2I  – 2e – = I2 – 2e – = I2 |
H2O2 + 2H3O 

H2O2 + H2SO4 + 2KI = 2H2O + I2 
Пример 2. Составьте уравнение реакции между перманганатом калия и пероксидом водорода в водном растворе, подкисленном серной кислотой.
| 2 | MnO4  + 8H3O + 8H3O  + 5e – = Mn 2 + 5e – = Mn 2  + 12H2O + 12H2O |
| 5 | H2O2 + 2H2O – 2e – = O2 + 2H3O  |
2MnO4 


2KMnO4 + 3H2SO4 + 5H2O2 = 2MnSO4 + 8H2O + 5O2 
Пример 3. Составьте уравнение реакции пероксида водорода с йодидом натрия в растворе в присутствии гидроксида натрия.
| 3 | 6 | HO2  + H2O + 2e – = 3OH + H2O + 2e – = 3OH  |
| 1 | 2 | I  + 6OH + 6OH  – 6e – = IO3 – 6e – = IO3  + 3H2O + 3H2O |
3HO2 



3NaHO2 + NaI = 3NaOH + NaIO3
Без учета реакции нейтрализации между гидроксидом натрия и пероксидом водорода это уравнение часто записывают так:
Это же уравнение получится, если сразу (на стадии составления баланса) не принимать во внимание образование гидропероксид-ионов.
Пример 4. Составьте уравнение реакции, протекающей при добавлении диоксида свинца к раствору пероксида водорода в присутствии гидроксида калия.
Диоксид свинца PbO2 – очень сильный окислитель, особенно в кислотной среде. Восстанавливаясь в этих условиях, он образует ионы Pb 2 

| 1 | PbO2 + 2H2O + 2e – = [Pb(OH)3]  + OH + OH  |
| 1 | HO2  + OH + OH  – 2e – = O2 + H2O – 2e – = O2 + H2O |
PbO2 + H2O + HO2 

Без учета образования гидропероксид-ионов уравнение записывается так:
PbO2 + H2O2 + OH 


Если по условию задания добавляемый раствор пероксида водорода был щелочным, то молекулярное уравнение следует записывать так:
PbO2 + H2O + KHO2 = K[Pb(OH)3] + O2
Если же в реакционную смесь, содержащую щелочь, добавляется нейтральный раствор пероксида водорода, то молекулярное уравнение может быть записано и без учета образования гидропероксида калия:
PbO2 + KOH + H2O2 = K[Pb(OH)3] + O2
Среди окислительно-восстановительных реакций выделяют реакции дисмутации (диспропорционирования, самоокисления-самовосстановления).
| Реакции дисмутации – ОВР, в которых часть атомов одного и того же элемента в одной и той же степени окисления восстанавливается, а часть – окисляется. |
Примером известной вам реакции дисмутации является реакция хлора с водой:
Cl2 + H2O 
В этой реакции половина атомов хлора(0) окисляется до степени окисления +I, а вторая половина восстанавливается до степени окисления –I:
Составим методом электронно-ионного баланса уравнение аналогичной реакции, протекающей при пропускании хлора через холодный раствор щелочи, например KOH:
| 1 | Cl2 + 2e – = 2Cl  |
| 1 | Cl2 + 4OH  – 2e – = 2ClO – 2e – = 2ClO  + 2H2O + 2H2O |
2Cl2 + 4OH 


Все коэффициенты в этом уравнении имеют общий делитель, следовательно:
Cl2 + 2OH 


Cl2 + 2KOH = KCl + KClO + H2O
Дисмутация хлора в горячем растворе протекает несколько иначе:
10

2
 – 10e – = 2ClO3
– 10e – = 2ClO3  + 6H2O
+ 6H2O3Cl2 + 6OH 


3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Большое практическое значение имеет дисмутация диоксида азота при его реакции c водой (а) и с растворами щелочей (б):
1
 + 2H3O
+ 2H3O 
1
 – e – = NO3
– e – = NO3  + H2O
+ H2O1

1

2NO2 + 2H2O = NO3 

2NO2 + 2OH 


2NO2 + H2O = HNO3 + HNO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Реакции дисмутации протекают не только в растворах, но и при нагревании твердых веществ, например, хлората калия:
2
6
Еще один тип реакций, протекающих при нагревании твердых веществ – внутримолекулярные ОВР.
| Внутримолекулярные ОВР – ОВР, в которых атомы-окислители и атомы-восстановители входят в состав одного и того же вещества. |
Характерным и очень эффектным примером внутримолекулярной ОВР является реакция термического разложения дихромата аммония (NH4)2Cr2O7. В этом веществе атомы азота находятся в своей низшей степени окисления (–III), а атомы хрома – в высшей (+VI). При комнатной температуре это соединение вполне устойчиво, но при нагревании интенсивно разлагается. При этом хром(VI) переходит в хром(III) – наиболее устойчивое состояние хрома, а азот(–III) – в азот(0) – также наиболее устойчивое состояние. С учетом числа атомов в формульной единице уравнения электронного баланса:
1
1
а само уравнение реакции:
(NH4)2Cr2O7 = Cr2O3 + N2 

Другой важный пример внутримолекулярной ОВР – термическое разложение перхлората калия KClO4. В этой реакции хлор(VII), как и всегда, когда он выступает в роли окислителя, переходит в хлор(–I), окисляя кислород(–II) до простого вещества:
4
8
и, следовательно, уравнение реакции
KClO4 = KCl + 2O2
Аналогично разлагается при нагревании и хлорат калия KClO3, если разложение проводить в присутствии катализатора (MnO2): 2KClO3 = 2KCl + 3O2
В отсутствие катализатора протекает реакция дисмутации.
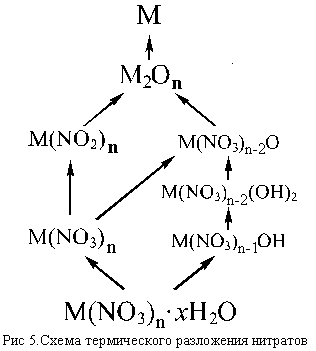
К группе внутримолекулярных ОВР относятся и реакции термического разложения нитратов.
Обычно процессы, протекающие при нагревании нитратов довольно сложны, особенно в случае кристаллогидратов. Если в кристаллогидрате молекулы воды удерживаются слабо, то при слабом нагревании происходит обезвоживание нитрата [например, LiNO3 . 3H2O и Ca(NO3)2 4H2O обезвоживаются до LiNO3 и Ca(NO3)2], если же вода связана прочнее [как, например, в Mg(NO3)2 . 6H2O и Bi(NO3)3 . 5H2O], то происходят своего рода реакции » внутримолекулярного гидролиза» с образованием основных солей – гидроксид-нитратов [Mg(NO3)OH и Bi(NO3)2OH], которые при дальнейшем нагревании могут переходить в оксид-нитраты <[Be4(NO3)6O] и [Bi6O6](NO3)6>, последние при более высокой температуре разлагаются до оксидов.
Безводные нитраты при нагревании могут разлагаться до нитритов (если они существуют и при этой температуре еще устойчивы), а нитриты – до оксидов. Если нагревание проводится до достаточно высокой температуры, или соответствующий оксид малоустойчив (Ag2O, HgO), то продуктом термического разложения может быть и металл (Cu, Cd, Ag, Hg).
Несколько упрощенная схема термического разложения нитратов показана на рис. 5.
Примеры последовательных превращений, протекающих при нагревании некоторых нитратов (температуры приведены в градусах Цельсия):
KNO3 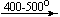
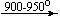
Ca(NO3)2 . 4H2O 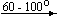
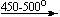
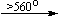
Mg(NO3)2 . 6H2O 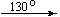
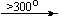
Cu(NO3)2 . 6H2O 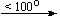

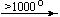
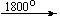
Bi(NO3)3 . 5H2O 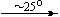
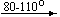
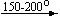
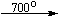
Несмотря на сложность происходящих процессов, при ответе на вопрос, что получится при » прокаливании» (то есть при температуре 400 – 500 o С) соответствующего безводного нитрата, обычно руководствуются следующими предельно упрощенными правилами:
1) нитраты наиболее активных металлов (в ряду напряжений – левее магния) разлагаются до нитритов;
2) нитраты менее активных металлов (в ряду напряжений – от магния до меди) разлагаются до оксидов;
3) нитраты наименее активных металлов (в ряду напряжений – правее меди) разлагаются до металла.
Используя эти правила, следует помнить, что в таких условиях
LiNO3 разлагается до оксида,
Be(NO3)2 разлагается до оксида при более высокой температуре,
из Ni(NO3)2 помимо NiO может получиться и Ni(NO2)2,
Mn(NO3)2 разлагается до Mn2O3,
Fe(NO3)2 разлагается до Fe2O3;
из Hg(NO3)2 кроме ртути может получиться и ее оксид.
Рассмотрим типичные примеры реакций, относящихся к этим трем типам:
KNO3 KNO2 + O2
| 2 | N +V +2e– = N +III |
| 1 | 2O– II – 4e– = O2 |
2KNO3 = 2KNO2 + O2
Zn(NO3)2 ZnO + NO2 
| 4Ѕ | N +V + e– = N +IV |
| 1Ѕ | 2O– II – 4e– = O2 |
2Zn(NO3)2 = 2ZnO + 4NO2 
AgNO3 Ag + NO2 
| 2 | Ag +1 + e– = Ag |
N +5 + e– = N +4
2AgNO3 = 2Ag + 2NO2 + O2
| ОВР конмутации – ОВР, в которых происходит выравнивание степени окисления атомов одного и того же элемента, находившихся до реакции в разных степенях окисления. |
Эти реакции могут быть как межмолекулярными, так и внутримолекулярными. Например, внутримолекулярные ОВР, протекающие при термическом разложении нитрата и нитрита аммония, относятся к реакциям конмутации, так как здесь происходит выравнивание степени окисления атомов азота:
NH4NO3 = N2O 

NH4NO2 = N2 

При более высокой температуре (250 – 300 o С) нитрат аммония разлагается до N2 и NO, а при еще более высокой (выше 300 o С) – до азота и кислорода, и в том и в другом случае образуется вода.
Примером межмолекулярной реакции конмутации является реакция, протекающая при сливании горячих растворов нитрита калия и хлорида аммония:
NH4 

Если проводить аналогичную реакцию, нагревая смесь кристаллических сульфата аммония и нитрата кальция, то, в зависимости от условий, реакция может протекать по-разному:
Первая и третья из этих реакций – реакции конмутации, вторая – более сложная реакция, включающая как конмутацию атомов азота, так и окисление атомов кислорода. Какая из реакций будет протекать при температуре выше 250 o С, зависит от соотношения реагентов.
Реакции конмутации, приводящие к образованию хлора, протекают при обработке соляной кислотой солей кислородсодержащих кислот хлора, например:
Также по реакции конмутации образуется сера из газообразных сероводорода и диоксида серы:
ОВР конмутации довольно многочисленны и разнообразны – к ним относятся даже некоторые кислотно-основные реакции, например:
Для составления уравнений ОВР конмутации используется как электронно-ионный, так и электронный баланс, в зависимости от того, в растворе протекает данная реакция или нет.
Изучая главу IX, вы познакомились с электролизом расплавов различных веществ. Так как подвижные ионы присутствуют и в растворах, электролизу могут быть подвергнуты также растворы различных электролитов.
Как при электролизе расплавов, так и при электролизе растворов, обычно используют электроды, изготовленные из материала, не вступающего в реакцию (графита, платины и т. п.), но иногда электролиз проводят и с » растворимым» анодом. » Растворимый» анод используют в тех случаях, когда необходимо получить электрохимическим способом соединение элемента, из которого изготовлен анод. При электролизе имеет большое значение разделены анодное и катодное пространство, или электролит в процессе реакции перемешивается – продукты реакции в этих случаях могут оказаться разными.
Рассмотрим важнейшие случаи электролиза.
1. Электролиз расплава NaCl. Электроды инертные (графитовые), анодное и катодное пространства разделены. Как вы уже знаете, в этом случае на катоде и на аноде протекают реакции:
K: Na 
A: 2Cl 
Записав таким образом уравнения реакций , протекающих на электродах, мы получаем полуреакции, с которыми можем поступать точно так же, как в случае использования метода электронно-ионного баланса:
K:
 + e – = Na
+ e – = NaA:
 – 2e – = Cl2
– 2e – = Cl2Сложив эти уравнения полуреакций, получаем ионное уравнение электролиза
2Na 

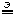
а затем и молекулярное
2NaCl 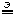
В этом случае катодное и анодное пространства должны быть разделены для того, чтобы продукты реакции не реагировали между собой. В промышленности эта реакция используется для получения металлического натрия.
2. Электролиз расплава K2CO3. Электроды инертные (платиновые). Катодное и анодное пространства разделены.
K:
 + e – = K
+ e – = KA:
 – 4e – = 2CO2
– 4e – = 2CO2  + O2
+ O2
4K+ + 2CO3 2 
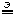


2K2CO3 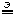

3. Электролиз воды (H2O). Электроды инертные.
K:
 + 2e – = H2 + 2H2O
+ 2e – = H2 + 2H2OA:
 – 4e – = O2 + 2H2O
– 4e – = O2 + 2H2O4H3O 

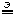


2H2O 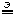

Вода – очень слабый электролит, в ней содержится очень мало ионов, поэтому электролиз чистой воды протекает крайне медленно.
4. Электролиз раствора CuCl2. Электроды графитовые. В системе присутствуют катионы Cu 2 





При электролизе растворов простые (одноатомные) анионы разряжаются (окисляются) раньше, чем сложные (многоатомные) ионы.
Следовательно в нашем случае на анода будут разряжаться хлоридные ионы.
K:
 + 2e – = Cu
+ 2e – = CuA:
 – 2e – = Cl2
– 2e – = Cl2Cu 2 

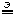
CuCl2 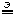
5. Электролиз раствора CuSO4. Электроды графитовые.
В водных растворах за счет автопротолиза воды (2H2O 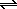







K:
 + 2e – = Cu
+ 2e – = CuK:
 + 2e – = Cu
+ 2e – = CuA:

A:

 + 6H2O
+ 6H2O 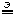 2Cu + O2
2Cu + O2  + 4H3O
+ 4H3O 
 + 2H2O
+ 2H2O 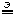 2Cu + O2
2Cu + O2  + 4H
+ 4H 
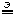 2Cu + O2
2Cu + O2  + H2SO4
+ H2SO4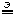 2Cu + O2
2Cu + O2  + H2SO4
+ H2SO4На катоде выделяется медь, на аноде – кислород, а в растворе накапливается серная кислота.
Ионы металлов, стоящих в ряду напряжений правее водорода, при электролизе растворов солей разряжаются.
В принципе ионы металлов, стоящих в ряду напряжений левее водорода, при электролизе водных растворов не должны разряжаться. В этих случаях должен был бы выделяться водород. Практически, из-за специфических особенностей разряда ионов водорода, при электролизе выделяются и более активные металлы.
Ионы металлов, стоящих в ряду напряжений между алюминием и водородом при электролизе растворов солей разряжаются вместе с водородом.
При этом, чем активнее металл, тем больше водорода выделяется, и тем большая часть электрической энергии расходуется бесполезно.
6. Электролиз раствора NiBr2. Электроды графитовые. Катодное и анодное пространства разделены.
K:
 + 2e – = Ni
+ 2e – = NiA:
 – 2e – = Br2
– 2e – = Br2Ni 2 

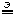
NiBr2 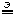
Одновременно с этим на катоде выделяется водород, в растворе накапливаются гидроксид-ионы, и, как следствие, протекает побочная реакция образования нерастворимого гидроксида никеля.
Ионы металлов, стоящие в ряду напряжений до алюминия при электролизе не разряжаются.
7. Электролиз раствора Na2SO4. Электроды платиновые. Раствор перемешивается.
В этом случае на катоде разряжаются не ионы натрия, а ионы оксония (2H3O 

K:

A:

10H2O 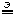



Так как раствор перемешивается, происходит реакция нейтрализации. В итоге получаем
2H2O 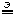

то есть, реакцию электролиза воды. При электролизе воды для повышения ее электропроводности в нее специально добавляют соли с неразряжающимися катионами и анионами, что значительно ускоряет процесс электролиза.
8. Электролиз раствора CuSO4. Анод медный.
K:
 + 2e – = Cu
+ 2e – = CuA:

В результате сложения уравнений полуреакций мы можем прийти к ошибочному выводу, что ничего не происходит. На самом деле эти полуреакции описывают реальный технологический процесс электролитического рафинирования (очистки) меди: с катода, содержащего примеси на анод переходят только ионы меди.


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
http://gomolog.ru/reshebniki/8-klass/zadachnik-kuznecova-2020/7-34.html
http://www.chem.msu.ru/rus/school/zhukov/18a.html