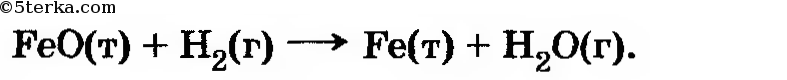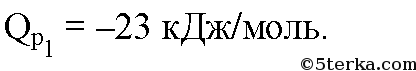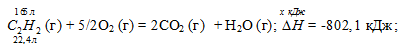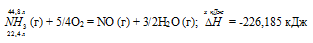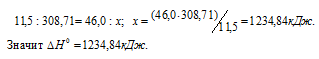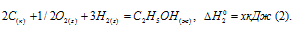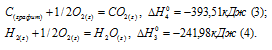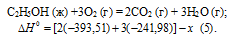8*. Исходя из следующих данных: вычислите тепловой эффект реакции:
8*. Исходя из следующих данных:  вычислите тепловой эффект реакции:
вычислите тепловой эффект реакции:

задача №8
к главе «Глава 3. Химические реакции. §12. Почему протекают химические реакции».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Составление термохимического уравнения реакции и вычисление теплот образования веществ
Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1537441f5a1ead • Your IP : 85.95.188.35 • Performance & security by Cloudflare
http://buzani.ru/zadachi/khiniga-shimanovich/913-termokbimicheskie-uravnenia-teplota-obrazovanie-88-94
http://gomolog.ru/reshebniki/1-kurs/shimanovich-2014/83.html
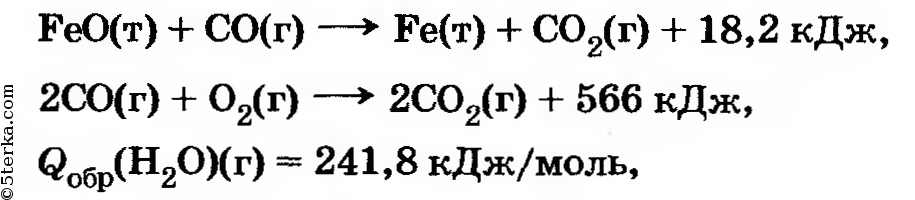 вычислите тепловой эффект реакции:
вычислите тепловой эффект реакции: