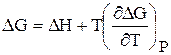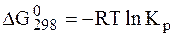Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
Зависимость константы равновесия от температуры
Под влиянием внешнего воздействия химическое равновесие, будучи динамическим, смещается. Согласно принципу Ле – Шателье повышение температуры смещает химическое равновесие в сторону эндотермического процесса.
Температура также оказывает влияние на константу равновесия. Изучение влияния температуры на химическое равновесие является одной из основных задач термодинамики.
Влияние температуры на константу равновесия вытекает из зависимости DG 0 = f(Т) 0 , которая описывается уравнением Гиббса – Гельмгольца:
и которое для стандартных условий будет иметь вид:
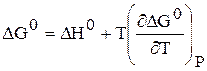
Воспользуемся уравнением изотермы при стандартных условиях:
DG 0 = – RT lnKp (6.178)
Продифференцируем уравнение изотермы по температуре при Р = const

Значения DG 0 и 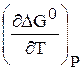
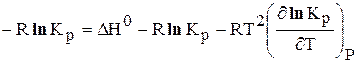
После преобразования получим уравнение изобары Вант –
Гоффа: 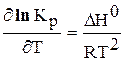
Аналогично можно вывести уравнение изохоры:

Если системы будут представлять собой реальные газы, жидкости или твердые тела, то в уравнения (6.188, 6.189) будут входить Kf и Ка, которые выражены через фугитивность и активности реагирующих веществ.
Так как Кр не зависит от давления, то частная производная в уравнениях (18, 19) может быть заменена на полную:
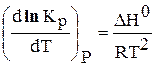
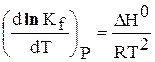
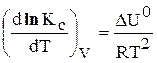

Выражения 6.190 и 6.191 – уравнения изобары Вант – Гоффа, а выражения 6.192 и 6.193 – уравнения изохоры Вант – Гоффа в дифференциальной форме.
Остановимся на рассмотрении уравнения изобары (6.190).
Оно устанавливает связь между изменением константы равновесия с температурой и тепловым эффектом реакции.
Как видно из уравнения (6.190), знак производной 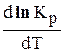
1. Если реакция в прямом направлении протекает с выделением тепла (экзотермическая), т.е. DН 0, то 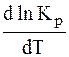
Это означает, что с ростом температуры константа равновесия Кр увеличивается, следовательно, увеличивается выход продуктов, равновесие смещается в прямом направлении, т.е. также в сторону эндотермического эффекта. Таким образом, при повышении температуры во всех случаях равновесие смещается в сторону поглощения тепла, что согласуется с известным принципом Ле – Шателье.
3. Если реакция протекает без поглощения и выделения теплоты, т.е. DН = 0, то 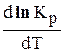
Поэтому, очевидно, что чем меньше DН реакции, тем слабее влияет температура на константу равновесия и на смещение равновесия.
Таким образом, направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта, а степень смещения равновесия определяется величиной теплового эффекта.
Для проведения количественных расчетов зависимости константы равновесия Кр от температуры надо проинтегрировать уравнение изобары, разделив предварительно переменные
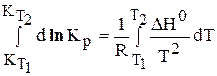
Если процесс проводится при температуре, отличной от стандартных условий, т.е. DН 0 = DН 0 Т, то тепловой эффект реакции определяется по уравнению Кирхгофа:

Если DН 0 сравнительно мало изменяется с температурой, можно использовать среднее значение теплоты реакции ( 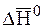
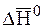
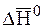
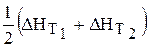
Такое допущение справедливо для небольшого интервала температур или в том случае, когда при реакции незначительно меняется теплоемкость системы.
После интегрирования уравнения (6.194) получается уравнение изобары в интегральной форме:

С помощью этого уравнения можно вычислить константу равновесия при любой температуре 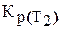
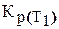


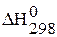
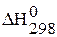
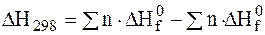
|
При Т = 298 К легко определить Кр(298). Для этого надо с помощью стандартных изобарных потенциалов образования участников реакции определить 
Если же при интегрировании уравнения изобары вместо определенного интеграла взять неопределенный, то получим:

Из этого уравнения (25) следует, что ln Kp линейно зависит от обратной величины абсолютной температуры, причем тангенс угла наклона прямой (Ðb) равен:

а) Если реакция эндотермическая, т.е. если DН > 0, tgb 90 (рис. 6.19,а)
б) Если реакция экзотермическая, т.е. если DН 0
Ðb 2 + DС / Т –2 (6.201)
(объединенное уравнение DСр для органических и неорганических соединений).
После интегрирования уравнения Кирхгоффа, получим:
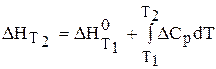
DН = DН 0 + DаТ + 1/2DвТ 2 + 1/3DСТ 3 – DС / Т –1 , (6.203)
где DН 0 является константой интегрирования и является теплотой реакции при 0 К.
Подставляя полученное уравнение DН = f(T) (6.203) в уравнение (6.194) и интегрируя в пределах от Т1 = 0 до Т2 = Т получим:
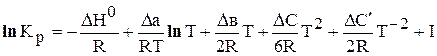
где I – константа интегрирования.
Очевидно, чтобы провести расчет Кр по уравнению (6.204) необходимо определить величины DН 0 и константу интегрирования – I.
Чтобы определить I, необходимо знать Кр при какой-нибудь одной температуре, например Т = 298 К. Подставляя это значение Кр(298) в уравнение (6.204) можно вычислить постоянную I, которая является постоянной для данной реакции. Затем, зная для данной реакции DН 0 и I, можно рассчитать Кр при любой температуре.
Константа равновесия, зависимость от температуры

Зависимость константы равновесия от температуры
- Температурная зависимость константы равновесия Влияние температуры на наиболее распространенную форму константы равновесия можно объяснить точным и точным термодинамическим соотношением.
- Зависимость константы равновесия от температуры выражается уравнением изобары реакции (название «изобара» обозначает постоянное давление во время дифференцирования). (212) тф ‘ Где 1 p / C — натуральный логарифм константы равновесия, K \ AN — изменение энтальпии в результате реакции (тепловой эффект реакции).
R — универсальная газовая постоянная. Людмила Фирмаль
- Т — абсолютная температура. \ N является положительным для эндотермических реакций и отрицательным для экзотермических реакций. Уравнение (2.12) показывает, что константа равновесия увеличивается или уменьшается в зависимости от знака теплового эффекта реакции.
Другими словами, когда температура поднимается, она будет только увеличиваться и уменьшаться до определенной температуры и начнет изменяться в противоположном направлении. Так, например, диссоциация муравьиной кислоты максимальна при 24,4 ° С, уксусной кислоты — 22,5 ° С, диссоциация воды при повышении температуры увеличивается только до 238,8 ° С, а затем начинает уменьшаться.
Температурная зависимость константы равновесия имеет экстремальное значение. Людмила Фирмаль




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
http://lektsia.com/5×3887.html
http://lfirmal.com/zavisimost-konstanty-ravnovesiya-ot-temperatury-2/