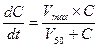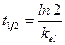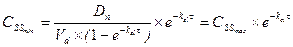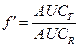Порядок реакции. Вывод и анализ кинетического уравнения первого порядка.
Для того, чтобы записать кинетическое уравнение, необходимо экспериментально определить величину константы скорости и показателей степени при концентрациях реагирующих веществ. Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции есть частный порядок реакции по данному компоненту. Сумма показателей степени в кинетическом уравнении химической реакции представляет собой общий порядок реакции. Стехиометрическое уравнение реакции представляет собой уравнение материального баланса и никоим образом не может определять характера протекания этой реакции во времени.
В химической кинетике принято классифицировать реакции по величине общего порядка реакции. Рассмотрим зависимость концентрации реагирующих веществ от времени для необратимых (односторонних) реакций нулевого, первого и второго порядков.
Рассмотрим зависимость от времени концентрации исходного вещества А для случая реакции первого порядка А ––> В. Реакции первого порядка характеризуются кинетическим уравнением вида:
После интегрирования выражения получаем:
Константу интегрирования g определим из начальных условий: в момент времени t = 0 концентрация С равна начальной концентрации Со. Отсюда следует, что g = ln Со. Получаем:
Т.о., логарифм концентрации для реакции первого порядка линейно зависит от времени и константа скорости численно равна тангенсу угла наклона прямой к оси времени.
Из уравнения (II.9) легко получить выражение для константы скорости односторонней реакции первого порядка:
Еще одной кинетической характеристикой реакции является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной. Выразим t1/2 для реакции первого порядка, учитывая, что С = ½Со:
как видно из полученного выражения, период полупревращения реакции первого порядка не зависит от начальной концентрации исходного вещества.
Общие положения и закономерности катализа.
Катализ – явление изменения скорости химической реакции в присутствии веществ, состояние и количество которых после реакции остаются неизменными.
Вещество, входящее в структуру активированного комплекса, но стехиометрически не являющееся реагентом, называется катализатором. Для всех катализаторов характерны такие общие свойства, как специфичность и селективность действия.
Специфичность катализатора заключается в его способности ускорять только одну реакцию или группу однотипных реакций и не влиять на скорость других реакций. Так, например, многие переходные металлы (платина, медь, никель, железо и т.д.) являются катализаторами для процессов гидрирования; оксид алюминия катализирует реакции гидратации и т.д.
Селективность катализатора – способность ускорять одну из возможных при данных условиях параллельных реакций. Благодаря этому можно, применяя различные катализаторы, из одних и тех же исходных веществ получать различные продукты:
Причиной увеличения скорости реакции при положительном катализе является уменьшение энергии активации при протекании реакции через активированный комплекс с участием катализатора.
Если предположить, что предэкспоненциальные множители в уравнении Аррениуса для каталитической и некаталитической реакций близки, то для отношения констант скорости можно записать:
Если ΔEA = –50 кДж/моль, то отношение констант скоростей составит 2,7·10 6 раз (действительно, на практике такое уменьшение EA увеличивает скорость реакции приблизительно в 105 раз).
Необходимо отметить, что наличие катализатора не влияет на величину изменения термодинамического потенциала в результате процесса и, следовательно, никакой катализатор не может сделать возможным самопроизвольное протекание термодинамически невозможного процесса (процесса, ΔG (ΔF) которого больше нуля). Катализатор не изменяет величину константы равновесия для обратимых реакций; влияние катализатора в этом случае заключается только в ускорении достижения равновесного состояния.
В зависимости от фазового состояния реагентов и катализатора различают гомогенный и гетерогенный катализ.
Энергетическая диаграмма химической реакции без катализатора (1)
и в присутствии катализатора (2).
6. Определите степень электролитической диссоциации фтористоводородной кислоты в 0,1 М растворе. Константа диссоциации кислоты равна 7,4∙10 -4 .
7. Рассчитайте молярную электрическую проводимость при бесконечно большом разбавлении для LiBr, если λ∞(KBr) = 151,9; λ∞(K2SO4) = 153,3; λ∞( Li2SO4) = 118,5 Ом -1 ∙см 2 .
Для получения выражения
λ∞(LiBr) = λLi + + λBr — надо вычесть (3) –(2) и добавить (1):
8. Вычислите константу равновесия реакции 2KBr + Cl2 = 2KCl + Br2 при 25 0 С, если
Cl2 + 2e — = 2Cl — , φ 0 1 = 1,36 В
Br2 + 2e — = 2Br — , φ 0 2 =1,09 В.
9. Элемент состоит из водородного электрода, погруженного в желудочный сок с неизвестной концентрацией водородных ионов, и каломельного электрода с насыщенным раствором КCl. Определите рН и С (Н + ) желудочного сока, если ЭДС элемента при 18 0 С 0,33 В. φ 18 калом. насыщ.= 0,2438 В.
С (Н + ) = 10 -pH = 0.027
Последнее изменение этой страницы: 2016-08-11; просмотров: 850
Кинетика элиминации первого и нулевого порядка
После введения лекарства в организм, его концентрация в крови вначале возрастает от нуля до некоторого уровня (при внутривенном введении это происходит практически мгновенно), а затем начинает снижаться, вследствие процессов элиминации и распределения.
Поскольку процесс элиминации лекарства носит вид ферментативной реакции (в случае его биотрансформации) или простого массопереноса (в случае экскреции), то очевидно, что он подчиняется законам химической кинетики и описывается классическим уравнением Михаэлиса-Ментен:
При этом, фактически, при введении в организм лекарственного средства возникают 2 возможные ситуации:
· Если уровень концентрации лекарства в организме (С) значительно меньше, чем величина его полумаксимальной скорости элиминации (V50), т.е. С — kt .
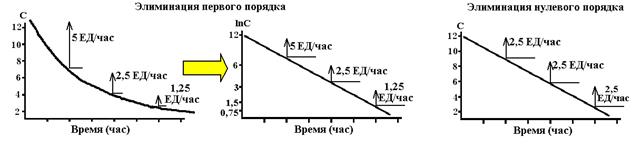
Таким образом, кинетикой элиминации первого порядка называют такой вид элиминации лекарства, при котором скорость удаления лекарственного вещества из крови пропорциональна его концентрации в организме и в единицу времени элиминируется постоянная доля (фракция) лекарства. График кинетики элиминации первого порядка имеет вид экспоненциальной кривой и может быть линеаризован в полулогарифмических координатах.
Большинство современных лекарств элиминируется кинетикой первого порядка.
· Если уровень концентрации лекарства в организме значительно превышает полумаксимальную скорость его элиминации (C>>V50), то уравнение сводится к виду:
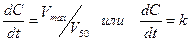
Это дифференциальное уравнение нулевого порядка, поэтому такой вид кинетики называют кинетикой элиминации нулевого порядка. Данное уравнение показывает, что скорость элиминации лекарства является величиной постоянной и не зависит от его концентрации в организме. Решая уравнение можно найти, что С=С0-kt.
Таким образом, кинетикой элиминации нулевого порядка называют такой вид элиминации, при котором скорость удаления лекарственного вещества из организма постоянна и в единицу времени элиминируется постоянное количество лекарственного вещества. График кинетики нулевого порядка имеет вид прямой линии в обычных координатах.
Кинетика элиминации нулевого порядка встречается относительно редко:
[ При инфузионном капельном введении лекарственного средства с постоянной скоростью. В этом случае она описывает фазу поступления лекарства.
[ При абсорбции лекарства из депо-форм (лекарственные формы продленного действия), которая протекает также с постоянной скоростью.
[ При насыщаемом метаболизме, т.е. в тех случаях, когда вводимая доза лекарства превышает возможности ферментов метаболизма по утилизации лекарственного средства. Такая ситуация возникает при введении высоких доз этанола, ацетилсалициловой кислоты, фенитоина.
Схема 9. Типичные формы фармакокинетических кривых при различных вариантах кинетики. Слева представлена кривая элиминации лекарства в соответствии с кинетикой первого порядка. В центре – та же кривая после преобразования оси концентраций в логарифмическую форму. Справа представлена кривая кинетики нулевого порядка.
1. Элиминация первого порядка. Термин «первого порядка» обозначает, что скорость элиминации пропорциональна концентрации вещества, то есть, чем выше концентрация тем выше количество вещества, которое элиминируется в единицу времени. В результате концентрация лекарства в плазме снижается во времени экспоненциально (см. рис. 1-5, слева). Лекарственные средства с элиминацией первого порядка характеризуются постоянной величиной периода полуэлиминации, независимо от содержания вещества в организме. Концентрация такого лекарства в крови за каждый период полусуществования будет понижаться на 50%. Большинство лекарств, при клиническом применении, обладают кинетикой первого порядка.
Элиминация нулевого порядка. Термин «нулевой порядок» обозначает, что скорость элиминации постоянна и не зависит от концентрации вещества (см. рис. 1-5, справа). Механизмы элиминации некоторых веществ являются насыщенными уже при низких концентрациях этих соединений. Как результат этого, концентрация таких лекарств в плазме понижается линейно во времени. Это характерно для этанола (при широком диапазоне его концентраций в организме) и фенитоина, а также для аспирина при высоких терапевтических или токсических концентрацях.
Основной целью лекарственной терапии является обеспечение в организме терапевтического уровня лекарства. Для этого используют введение вначале нагрузочной, а затем – поддерживающих доз лекарства. Напомним формулы для расчета этих доз:
При непрерывном внутрисосудистом введении между поддерживающей и нагрузочной дозами (скоростями введения) существует следующая зависимость:
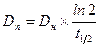
Период полуэлиминации (t½, мин -1 ) – это время, необходимое для снижения концентрации лекарственного вещества в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов. Обычно период полуэлиминации определяют из соотношения:
Все три показателя Vd, Cl и t½ связаны между собой следующими соотношениями:
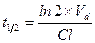
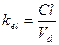
Концентрация лекарственного средства в плазме крови, которая достигается при условии, что скорость введения лекарства в организм уравновешивает скорость его выведения получила название стационарной концентрации лекарственного вещества(СSS). Из уравнения:
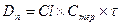
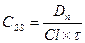
Таким образом, величина CSS прямо пропорциональна вводимой дозе и обратно пропорциональна интервалу между введениями лекарства. Поскольку лекарственное вещество вводится через дискретные интервалы времени, то очевидно, что величина СSS не будет постоянной, а начнет колебаться в каком-то диапазоне от максимального уровня (вскоре после введения лекарства) до минимального уровня перед очередным приемом лекарства. Эти границы колебаний не трудно рассчитать, они составляют:

Различают 3 вида эквивалентности:
[ Химическая (фармацевтическая) эквивалентность – означает, что 2 лекарственных препарата содержат одно и то же лекарственное вещество в равных количествах и в соответствии с действующими стандартами. При этом неактивные ингридиенты лекарственных препаратов могут различаться.
[ Биоэквивалентность – означает, что два химически эквивалентных лекарственных препарата различных производителей при введении в организм человека в равных дозах и по одинаковой схеме всасываются и поступают в системный кровоток в равной степени, т.е. обладают сопоставимыми показателями биодоступности.
[ Терапевтическая эквивалентность. Данное понятие означает, что 2 лекарственных препарата, содержащих одно и то же лекарственное средство, которые применяют в равных дозах и по одинаковой схеме вызывают сопоставимый терапевтический эффект. Терапевтическая эквивалентность не зависит от биоэквивалентности лекарственных препаратов. Два препарата могут быть биологически эквивалентны, но при этом иметь разную терапевтическую эквивалентность.
Основным критерием биоэквивалентности является отношение площадей под фармакокинетической кривой для двух изучаемых лекарственных средств, а также отношение максимальных концентраций этих лекарств в крови пациента:
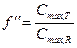
Считают, что допустимыми колебаниями этих параметров является диапазон 0,8-1,2 (т.е. биодоступность двух сравниваемых лекарств не должна различаться более чем на 20%).
Цитоплазматические рецепторы. Находятся в цитозоле клетки. Лиганд рецептора (липофильное вещество) проникает через ее мембрану и связывается с рецептором. В покое эти рецепторы экранированы особым белком теплового шока (hsp-белок). При связывании с лигандом рецептор освобождает этот белок и образует пары с другими рецепторами данного семейства. Затем, активированный рецептор поступает в ядро клетки, где связывается с особыми рецепторными последовательностями нуклеотидов ДНК и регулирует экспрессию генов. К данному семейству относятся рецепторы для стероидных гормонов, витаминов А и D, тиреоидных гормонов.
Трансмембранные рецепторы, связанные с ионными каналами. Представляют собой белки, которые формируют в мембране ионный канал. При взаимодействии лиганда с рецепторной субъединицей белка проницаемость ионного канала меняется. К данной группе рецепторов относят:
] Н-холинорецепторы, связанные с Na + -каналами. При взаимодействии с ацетилхолином рецептор открывает натриевый канал и под влиянием тока ионов натрия в клетку возникает деполяризация мембраны и генерируется потенциал действия.
] ГАМКА-рецепторы, которые связаны с Cl — -каналами. При взаимодействии с g-аминомасляной кислотой рецептор открывает канал и обеспечивает поступление в клетку ионов хлора. Возникает гиперполяризация мембраны и переход ее в состояние покоя.
Трансмембранные рецепторы, связанные с G-белками. Эти рецепторы состоят из 3 субъединиц. Рецепторный белок располагается на наружной стороне мембраны. При взаимодействии с лигандом он передает сигнал на внутримембранный G-белок, который за счет энергии ГТФ перемещается к внутренней стороне мембраны и изменяет активность эффекторных белков. Эффекторные белки расположены на внутренней стороне мембраны и представляют собой ферменты, которые образуют «вторичные мессенджеры» – молекулы-посредники, которые передают сигнал в клетку и вызывают развитие ответной реакции. В качестве эффекторных белков выступают:
] Аденилатциклаза – это фермент, который гидролизует АТФ с образованием циклического АМФ
] Гуанилатциклаза – это фермент, который гидролизует ГТФ с образованием цГМФ. Молекула цГМФ активирует в клетке цГМФ-зависимые протеинкиназы, которые также фосфорилируют белки.
Трансмембранные рецепторы-ферменты. Данный вид рецепторов представлен молекулами, состоящими из 2 субъединиц. Рецепторная субъединица располагается с наружной стороны мембраны, а каталитическая (т.е. обладающая ферментативногй активностью) – прошивает мембрану клетки насквозь. При взаимодействии с лигандом рецепторная субъединица активирует каталитическую часть молекулы. В качестве каталитической субъединицы выступают:
] Тирозинкиназы – ферменты, которые фосфорилируют остатки тирозина в молекулах белков. К такому типу рецепторов относится инсулиновый рецептор.
] Серин-треонинкиназы – ферменты, которые фосфорилируют остатки серина и треонина в молекулах белков. К такому типу относят некоторые из интерлейкиновых рецепторов.
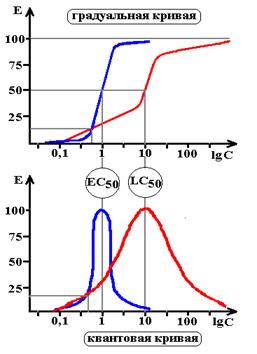
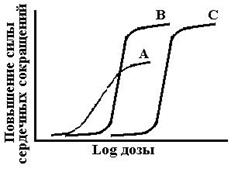
Градуальные кривые зависимости «доза-эффект». А – зависимость изменения частоты сердечных сокращений от дозы лекарства в нормальных координатах, В – та же кривая в полулогарифмических координатах (одна из шкал переведена в форму десятичных логарифмов), С – кривая связывания того же вещества с рецепторами миокарда.
Emax – максимальный эффект, Bmax – максимальное число связанных рецепторов, ЕС50 – концентрация лекарства при которой возникает эффект равный половине максимального, Kd – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов.
Схема 4. Сравнительная характеристика кардиотонических средств. Как следует из представленных графиков EC50,A
Вывод и анализ кинетического уравнения нулевого порядка
Из уравнений (4) и (5) видно, что критериями первого порядка реакции по реагенту А является линейная зависимость ln [ A ] – t или ln 
В тоже время по тангенсам углов наклона линейных зависимостей можно определить константы скорости.
Другой тест правильности выбранного первого порядка является постоянство константы скорости реакции, вытекающее из уравнения (5)
Размерность константы скорости первого порядка dim < k >= [1/ c ], [1/мин] или соответственно с -1 , мин -1
Третий тест основан на концентрационной зависимости времени полупревращения. Условие полупревращения [ A ] = 0,5[ A ]0 , тогда в соответствии с уравнением (5)
Можно видеть, что критерием первого порядка реакции является независимость времени полупревращения t ½ от начальной концентрации реагента [ A ]0.
Примерами подобных реакций первого порядка являются реакции изомеризации, а также реакции разложения некоторых сложных молекул в газовой фазе.
и в жидкой фазе, например, гидролиз трет-бутилбромида.
Для реакции A + B → C + D можно записать уравнение скорости
Обозначим [ A ]0 и [ B ]0 – начальными концентрациями реагентов А и В, а Х – количество прореагировавших А и В, тогда уравнение (1) приобретет вид
Разделяя переменные, имеем
Проинтегрируем левую часть этого уравнения методом неопределенных коэффициентов, для чего представим дробь
в виде суммы дробей
Решая совместно эти уравнения, имеем

Подставляя значения α и β в уравнение (3) и (4) и интегрируя полученные уравнения в соответствующих пределах
Из уравнения (5) видно, что критерием правильности выбранного второго порядка реакции является линейность зависимости

По тангенсу угла наклона этой зависимости можно определить константу скорости реакции. Другим критерием правильности выбранного второго порядка является постоянство значений k , вычисленных в соответствии с уравнением (5):
во всем диапазоне пар значений τ – х.
Размерность константы скорости второго порядка

Если вещества А и В взяты в равных количествах или реакция идет с участием одного вещества, например
то при постоянстве объема удобно использовать в качестве переменной концентрацию одного из исходных веществ
тогда кинетическое уравнение будет иметь вид
Интегрируя это уравнение в соответствующих пределах
приходим к выражению
Из уравнений (7) и (8) следует, что критериями правильности выбранного второго порядка являются линейный характер зависимости 1/[ A ] от t и постоянство значения k , вычисленных для различных пар значений [ A ] – t по формуле
Третий критерий правильности второго порядка основан на определении времени полупревращения t ½ . Так как [ A ] = 0.5[ A ]0, то в соответствии с уравнением (7)

Можно видеть, что критерием второго порядка является обратно пропорциональная зависимость между t ½ и начальной концентрацией реагента. В соответствии с выражениями (7) и (8) константы скорости второго порядка можно определить по тангенсу угла наклона зависимостей 

Имеется множество реакций протекающих по кинетике второго порядка:
и простой случай, соответствующий равенству исходных и текущих концентраций реагентов
Разделяя переменные и интегрируя
Из уравнения (3) видно, что критериями правильности выбранного третьего порядка является линейность зависимостей 

для всех пар значений t и [ A ] и обратно пропорциональная зависимость между временем полупревращения и квадратом начальной концентрации реагента
В соответствии с уравнением (3) константа скорости третьего порядка может быть определена по тангенсу угла наклона зависимости 

Интегрирование уравнения (1)
приводит к выражениям
Из уравнений (2) и (3) следует, что критериями нулевого порядка по реагенту А являются линейный характер зависимости [ A ] от t , постоянство k , вычисленного по формуле

Из уравнений (2) и (3) следует, что константа скорости нулевого порядка может быть определена по тангенсу угла наклона зависимостей [ A ]0 – [ A ] или [ A ] от времени
Сложные реакции представляют собой совокупность простых реакций. К сложным реакциям относятся обратимые реакции.
При кинетическом анализе сложных реакций руководствуются принципом независимости простых реакций, согласно которому каждая простая реакция, входящая в сложную ведет себя кинетически так, как если бы она была единственная.
в начальный момент времени концентрация реагента A составляет [ A ]0, а [ B ] = 0, то уравнение этой реакции запишется как
Выражая r через концентрацию [A] имеем


где X – количество молей вещества A в единице объеме, которое прореагировало к моменту τ и соответственно количество молей вещества B в единице объеме, которое образовалось к этому моменту. Преобразуя правую часть уравнения (2)

В условиях равновесия
При τ ® ¥ X стремится к своему равновесному значению X ® X ¥ . Тогда
где
Тогда кинетическое уравнение (3) примет вид
Интегрируя это уравнение в соответствующих пределах
и
В соответствии с выражениями (6) и (7) кинетические зависимости для A и B будут иметь следующий вид
Пользуясь интегральной формой кинетического уравнения (5) и соотношением 
Так, в соответствии с (5)
так как 
Подставляя последнее выражение в уравнение (8), имеем
Подставляя выражение (10) в уравнение (8), имеем
Рассмотрим систему параллельных реакций первого порядка
В соответствии с ранее принятыми обозначениями суммарная скорость расходования реагента A выразится уравнением
По форме уравнение (1) подобно кинетическому уравнению необратимой реакции первого порядка, поэтому его интегральная форма имеет вид.
Разрешая уравнение (2) относительно [ A ] имеем
Для определения констант k 1 и k 2 рассмотрим уравнения конкурирующих параллельных реакций.
Поделив почленно, левые и правые части уравнений (5) и (6), имеем уравнение 
Разделяя, левые и правые части уравнений (5) и (1), (6) и (7), приходим к очевидным равенствам

интегрирование которых дает уравнения:

Подставляя в последние уравнения выражение (4) приходим к равенствам
Уравнения (2) и (8) являются основой для определения абсолютных значений констант скорости конкурирующих реакций k 1 и k 2 . На первом этапе можно определить сумму констант скоростей k 1 + k 2 , пользуясь уравнением (2). Затем на основе линейных зависимостей между XB и X , а также XC и X определяют брутто константы 

Нетрудно показать, что для трех параллельных реакций первого порядка


Этот случай более сложен по сравнению с предыдущим. Рассмотрим систему параллельных реакций
Уравнение скорости расхода A в этой системе реакций с учетом его количества, прореагировавшего к моменту времени t (Х) имеет вид:
или с учетом преобразований
обозначая 
Разделяя переменные, приходим к выражению
Интегрируем левую часть уравнения (3) методом неопределенных коэффициентов, для чего представим левую её часть в виде суммы дробей.

так как 

Тогда 
Откуда 

С учетом (4) возвращаемся к уравнению (3)
Интегрирование уравнения (5) приводит к выражению
Откуда
или
Возвращаясь к соотношению 
Рассмотрим систему двух последовательных реакций первого порядка
В силу принципа независимости скорости расходования реагента A выражается уравнением скорости необратимой реакции первого порядка
Решение которого дается в виде


Уравнение скорости изменения концентрации промежуточных продуктов
Разделим почленно левые и правые части уравнений (3) и (1)
Уравнение (4) имеет признаки однородного уравнения первого порядка. Для его решения вводим обозначение
Подставляя последнее выражение в уравнение (4), имеем:
Разделяем переменные и интегрируем
и
тогда
и
или
Так как 
В тоже время в соответствии с уравнением (2)
Тогда уравнение (5) можно преобразовать в форму
Выведенные зависимости показывают, что в случае необратимых последовательных реакций уравнение для первого промежуточного продукта связано с характеристиками лишь первых двух стадий, оставаясь одинаковым при любом числе и характеристиках последующих стадий. При этом независимо от начальной концентрации реагента A , значение второй характеристики материального баланса 
Используя уравнение (5) можно найти 
Из анализа уравнения (6) следует, что при XA = 0 и XA = 1 

откуда
и значение максимума
Из выражений (8) и (9) видно, что положение и величина максимума промежуточного продукта в необратимых реакциях первого порядка зависит только от соотношения констант скоростей первых двух стадий. При этом, чем больше величина 

Уравнение образования продукта C :
Максимальная скорость 
Легко видеть, что это условие соответствует одновременно условию максимума концентрации B , определяемого уравнениями(8) и (9). Качественно проанализированные зависимости могут быть представлены графически.
Неэлементарные реакции состоят из ряда элементарных стадий, составляющих их механизм. Кинетика таких реакций определяется последовательностью элементарных стадий, их характером (обратимые, необратимые), природой реагентов, интермедиатов и продуктов реакции. При кинетическом анализе неэлементарных реакций возникает задача определения концентраций интермедиатов, играющих ключевую роль в образовании продуктов или расходовании реагентов. В качестве инструмента такого определения используется принцип квазистационарных концентраций Боденштейна – Семенова. Согласно этому принципу скорость изменения концентраций нестабильных интермедиатов пренебрежимо мала по сравнению со скоростью изменения концентраций реагентов и продуктов реакции и её можно считать равной нулю. Применение принципа стационарных концентраций к неэлементарным реакциям, протекающим по сложному механизму, позволяет исключить из кинетического описания процессов неизвестные концентрации интермедиатов и получить одно или некоторый минимум дифференциальных уравнений скорости, выраженных через подлежащие измерению концентрации реагентов и продуктов реакции.
Рассмотрим пример неэлементарной реакции, описываемой стехиометрией
и протекающей через образование интермедиата Q
Скорость реакции можно приравнять к скорости образования продукта B
В соответствии с принципом квазистационарных концентраций
откуда
Подставляя последнее выражение в уравнение (1) приходим к уравнению скорости реакции
Если экспериментально возможно непосредственно измерить скорость реакции, то обработку кинетических данных можно провести, преобразуя уравнение (3) как:
Последнее уравнение приводится к виду
Обрабатывая зависимость (4) в координатах 

http://mydocx.ru/2-23863.html
http://www.trotted.narod.ru/physchem/26.htm