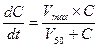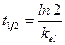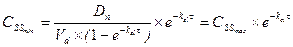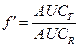Кинетика элиминации первого и нулевого порядка
После введения лекарства в организм, его концентрация в крови вначале возрастает от нуля до некоторого уровня (при внутривенном введении это происходит практически мгновенно), а затем начинает снижаться, вследствие процессов элиминации и распределения.
Поскольку процесс элиминации лекарства носит вид ферментативной реакции (в случае его биотрансформации) или простого массопереноса (в случае экскреции), то очевидно, что он подчиняется законам химической кинетики и описывается классическим уравнением Михаэлиса-Ментен:
При этом, фактически, при введении в организм лекарственного средства возникают 2 возможные ситуации:
· Если уровень концентрации лекарства в организме (С) значительно меньше, чем величина его полумаксимальной скорости элиминации (V50), т.е. С — kt .
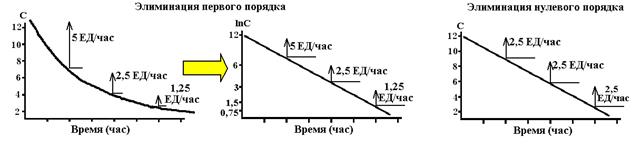
Таким образом, кинетикой элиминации первого порядка называют такой вид элиминации лекарства, при котором скорость удаления лекарственного вещества из крови пропорциональна его концентрации в организме и в единицу времени элиминируется постоянная доля (фракция) лекарства. График кинетики элиминации первого порядка имеет вид экспоненциальной кривой и может быть линеаризован в полулогарифмических координатах.
Большинство современных лекарств элиминируется кинетикой первого порядка.
· Если уровень концентрации лекарства в организме значительно превышает полумаксимальную скорость его элиминации (C>>V50), то уравнение сводится к виду:
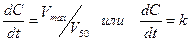
Это дифференциальное уравнение нулевого порядка, поэтому такой вид кинетики называют кинетикой элиминации нулевого порядка. Данное уравнение показывает, что скорость элиминации лекарства является величиной постоянной и не зависит от его концентрации в организме. Решая уравнение можно найти, что С=С0-kt.
Таким образом, кинетикой элиминации нулевого порядка называют такой вид элиминации, при котором скорость удаления лекарственного вещества из организма постоянна и в единицу времени элиминируется постоянное количество лекарственного вещества. График кинетики нулевого порядка имеет вид прямой линии в обычных координатах.
Кинетика элиминации нулевого порядка встречается относительно редко:
[ При инфузионном капельном введении лекарственного средства с постоянной скоростью. В этом случае она описывает фазу поступления лекарства.
[ При абсорбции лекарства из депо-форм (лекарственные формы продленного действия), которая протекает также с постоянной скоростью.
[ При насыщаемом метаболизме, т.е. в тех случаях, когда вводимая доза лекарства превышает возможности ферментов метаболизма по утилизации лекарственного средства. Такая ситуация возникает при введении высоких доз этанола, ацетилсалициловой кислоты, фенитоина.
Схема 9. Типичные формы фармакокинетических кривых при различных вариантах кинетики. Слева представлена кривая элиминации лекарства в соответствии с кинетикой первого порядка. В центре – та же кривая после преобразования оси концентраций в логарифмическую форму. Справа представлена кривая кинетики нулевого порядка.
1. Элиминация первого порядка. Термин «первого порядка» обозначает, что скорость элиминации пропорциональна концентрации вещества, то есть, чем выше концентрация тем выше количество вещества, которое элиминируется в единицу времени. В результате концентрация лекарства в плазме снижается во времени экспоненциально (см. рис. 1-5, слева). Лекарственные средства с элиминацией первого порядка характеризуются постоянной величиной периода полуэлиминации, независимо от содержания вещества в организме. Концентрация такого лекарства в крови за каждый период полусуществования будет понижаться на 50%. Большинство лекарств, при клиническом применении, обладают кинетикой первого порядка.
Элиминация нулевого порядка. Термин «нулевой порядок» обозначает, что скорость элиминации постоянна и не зависит от концентрации вещества (см. рис. 1-5, справа). Механизмы элиминации некоторых веществ являются насыщенными уже при низких концентрациях этих соединений. Как результат этого, концентрация таких лекарств в плазме понижается линейно во времени. Это характерно для этанола (при широком диапазоне его концентраций в организме) и фенитоина, а также для аспирина при высоких терапевтических или токсических концентрацях.
Основной целью лекарственной терапии является обеспечение в организме терапевтического уровня лекарства. Для этого используют введение вначале нагрузочной, а затем – поддерживающих доз лекарства. Напомним формулы для расчета этих доз:
При непрерывном внутрисосудистом введении между поддерживающей и нагрузочной дозами (скоростями введения) существует следующая зависимость:
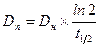
Период полуэлиминации (t½, мин -1 ) – это время, необходимое для снижения концентрации лекарственного вещества в крови ровно наполовину. При этом не играет роли каким путем достигается снижение концентрации – при помощи биотрансформации, экскреции или же за счет сочетания обоих процессов. Обычно период полуэлиминации определяют из соотношения:
Все три показателя Vd, Cl и t½ связаны между собой следующими соотношениями:
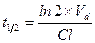
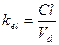
Концентрация лекарственного средства в плазме крови, которая достигается при условии, что скорость введения лекарства в организм уравновешивает скорость его выведения получила название стационарной концентрации лекарственного вещества(СSS). Из уравнения:
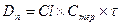
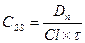
Таким образом, величина CSS прямо пропорциональна вводимой дозе и обратно пропорциональна интервалу между введениями лекарства. Поскольку лекарственное вещество вводится через дискретные интервалы времени, то очевидно, что величина СSS не будет постоянной, а начнет колебаться в каком-то диапазоне от максимального уровня (вскоре после введения лекарства) до минимального уровня перед очередным приемом лекарства. Эти границы колебаний не трудно рассчитать, они составляют:

Различают 3 вида эквивалентности:
[ Химическая (фармацевтическая) эквивалентность – означает, что 2 лекарственных препарата содержат одно и то же лекарственное вещество в равных количествах и в соответствии с действующими стандартами. При этом неактивные ингридиенты лекарственных препаратов могут различаться.
[ Биоэквивалентность – означает, что два химически эквивалентных лекарственных препарата различных производителей при введении в организм человека в равных дозах и по одинаковой схеме всасываются и поступают в системный кровоток в равной степени, т.е. обладают сопоставимыми показателями биодоступности.
[ Терапевтическая эквивалентность. Данное понятие означает, что 2 лекарственных препарата, содержащих одно и то же лекарственное средство, которые применяют в равных дозах и по одинаковой схеме вызывают сопоставимый терапевтический эффект. Терапевтическая эквивалентность не зависит от биоэквивалентности лекарственных препаратов. Два препарата могут быть биологически эквивалентны, но при этом иметь разную терапевтическую эквивалентность.
Основным критерием биоэквивалентности является отношение площадей под фармакокинетической кривой для двух изучаемых лекарственных средств, а также отношение максимальных концентраций этих лекарств в крови пациента:
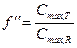
Считают, что допустимыми колебаниями этих параметров является диапазон 0,8-1,2 (т.е. биодоступность двух сравниваемых лекарств не должна различаться более чем на 20%).
Цитоплазматические рецепторы. Находятся в цитозоле клетки. Лиганд рецептора (липофильное вещество) проникает через ее мембрану и связывается с рецептором. В покое эти рецепторы экранированы особым белком теплового шока (hsp-белок). При связывании с лигандом рецептор освобождает этот белок и образует пары с другими рецепторами данного семейства. Затем, активированный рецептор поступает в ядро клетки, где связывается с особыми рецепторными последовательностями нуклеотидов ДНК и регулирует экспрессию генов. К данному семейству относятся рецепторы для стероидных гормонов, витаминов А и D, тиреоидных гормонов.
Трансмембранные рецепторы, связанные с ионными каналами. Представляют собой белки, которые формируют в мембране ионный канал. При взаимодействии лиганда с рецепторной субъединицей белка проницаемость ионного канала меняется. К данной группе рецепторов относят:
] Н-холинорецепторы, связанные с Na + -каналами. При взаимодействии с ацетилхолином рецептор открывает натриевый канал и под влиянием тока ионов натрия в клетку возникает деполяризация мембраны и генерируется потенциал действия.
] ГАМКА-рецепторы, которые связаны с Cl — -каналами. При взаимодействии с g-аминомасляной кислотой рецептор открывает канал и обеспечивает поступление в клетку ионов хлора. Возникает гиперполяризация мембраны и переход ее в состояние покоя.
Трансмембранные рецепторы, связанные с G-белками. Эти рецепторы состоят из 3 субъединиц. Рецепторный белок располагается на наружной стороне мембраны. При взаимодействии с лигандом он передает сигнал на внутримембранный G-белок, который за счет энергии ГТФ перемещается к внутренней стороне мембраны и изменяет активность эффекторных белков. Эффекторные белки расположены на внутренней стороне мембраны и представляют собой ферменты, которые образуют «вторичные мессенджеры» – молекулы-посредники, которые передают сигнал в клетку и вызывают развитие ответной реакции. В качестве эффекторных белков выступают:
] Аденилатциклаза – это фермент, который гидролизует АТФ с образованием циклического АМФ
] Гуанилатциклаза – это фермент, который гидролизует ГТФ с образованием цГМФ. Молекула цГМФ активирует в клетке цГМФ-зависимые протеинкиназы, которые также фосфорилируют белки.
Трансмембранные рецепторы-ферменты. Данный вид рецепторов представлен молекулами, состоящими из 2 субъединиц. Рецепторная субъединица располагается с наружной стороны мембраны, а каталитическая (т.е. обладающая ферментативногй активностью) – прошивает мембрану клетки насквозь. При взаимодействии с лигандом рецепторная субъединица активирует каталитическую часть молекулы. В качестве каталитической субъединицы выступают:
] Тирозинкиназы – ферменты, которые фосфорилируют остатки тирозина в молекулах белков. К такому типу рецепторов относится инсулиновый рецептор.
] Серин-треонинкиназы – ферменты, которые фосфорилируют остатки серина и треонина в молекулах белков. К такому типу относят некоторые из интерлейкиновых рецепторов.
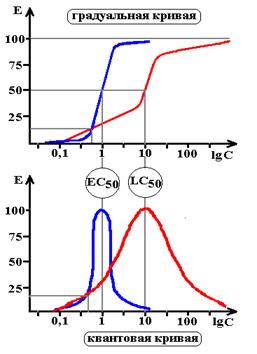
Градуальные кривые зависимости «доза-эффект». А – зависимость изменения частоты сердечных сокращений от дозы лекарства в нормальных координатах, В – та же кривая в полулогарифмических координатах (одна из шкал переведена в форму десятичных логарифмов), С – кривая связывания того же вещества с рецепторами миокарда.
Emax – максимальный эффект, Bmax – максимальное число связанных рецепторов, ЕС50 – концентрация лекарства при которой возникает эффект равный половине максимального, Kd – константа диссоциации вещества от рецептора, при которой связано 50% рецепторов.
Схема 4. Сравнительная характеристика кардиотонических средств. Как следует из представленных графиков EC50,A
КИНЕТИЧЕСКИЕ УРАВНЕНИЯ РЕАКЦИЙ
Рассмотрим кинетические закономерности необратимых реакций. Реакция характеризуется кинетическим уравнением, которое позволяет рассчитать константу скорости в любой момент времени от ее начала и период полупревращения.
Реакции нулевого порядка. Реакций нулевого порядка очень мало, большая их часть является гетерогенными реакциями. Нулевой порядок реакции указывает на независимость скорости реакции от концентрации реагентов.
Такая закономерность возможна когда:
— концентрация реагента поддерживается постоянной (насыщенный раствор).
— когда реакция протекает не совсем обычным путем (фотохимические, каталитические).
Для реакции А→ продукты выражение скорости как функции концентрации имеет вид:
Разделив переменные получим,
Запишем интеграл, взяв пределы концентрации в интервале времени (0 и 


Где к0 — константа скорости реакции нулевого порядка, моль/(л
Важной количественной характеристикой протекания реакций во времени является время полупревращения 
Эта величина определяется промежутком времени, в течение которого начальная концентрация 
Если уравнение кинетики реакции известно, время полупревращения нетрудно выразить через константу скорости. Для этого в уравнении кинетики подставляют значения 
РЕАКЦИИ ПЕРВОГО ПОРЯДКА
В реакции первого порядка скорость пропорциональна концентрации одного реагента. Для такой реакции, как А→ продукты выражение скорости как функции концентрации имеет вид:
Далее схема рассуждений аналогична предыдущей: разделим переменные, запишем интеграл, проинтегрируем и получим выражение для константы скорости реакции первого порядка, 
Период полупревращения не зависит от начальной концентрации и равен:
РЕАКЦИИ ВТОРОГО ПОРЯДКА
Они бывают двух типов: в одном случае реагируют друг с другом две молекулы одного и того же вещества, в другом — две молекулы разных веществ.
Для такой реакции как 2А→ продуктывыражение скорости имеет вид:
Далее, рассуждая по известной нам схеме получим:
Для реакции А + В → продукты выражения скорости будет иметь вид:

СЛОЖНЫЕ РЕАКЦИИ
Если реакция сложная, то для изучения зависимости ее скорости от концентрации реагентов необходимо знать кинетический механизм, т.е. элементарные стадии через которые осуществляется изучаемое превращение.
По кинетическому механизму все сложные реакции подразделяются на следующие типы:
Последовательными называются сложные реакции, в которых продукт первой стадии вступает в реакцию второй стадии, продукт второй стадии вступает в третью и т. д. пока не образуется продукт реакции.
Рассмотрим простейшую последовательную реакцию, состоящую из двух мономолекулярных стадий:
Кинетика этой реакции списывается системой из трех дифференциальных уравнений, которые составляются для скорости простых реакций, на основе закона действующих масс:

а — концентрация вещества А при τ =0;
(a-x)— концентрация вещества А к моменту времени τ;
(x-y)-концентрация вещества Вк моменту времени τ;
y-концентрация вещества Pк моменту времени.
Если реакция протекает с образованием промежуточных продуктов, концентрации которых вблизи максимума изменяются незначительно, то можно считать, что они стационарны. Из этого следует:
Интегрирование системы уравнений с учетом принципа стационарных концентраций дает следующее решение:
1. При 

2. При 

Кинетические кривые отражают наиболее характерные особенности последовательных реакций. Концентрация исходного вещества (А) монотонно убывает.
Концентрация промежуточного вещества (В) в начале возрастает, достигает максимума, затем падает. Концентрация конечного продукта (P) монотонно возрастает со временем.
Рис.3 Кинетические кривые для последовательной реакции.
В точке максимума выполняется соотношение:
Величина 



Обычный путь лекарственного вещества в организме можно рассматривать как последовательность двух процессов: всасывание из желудка в кровь (характеризуется константой всасывания квс) и выведение из крови в мочу (характеризуется константой выведения квв):




Параллельные реакции. Реакции называются таковыми, если в каждой из них принимает участие одно и тоже исходное вещество, которое одновременно по различным направлениям превращается в разные продукты.
Возможность таких реакций определяется термодинамической вероятностью (∆G
Кинетические уравнения. Тема: Порядок реакции. Период полупревращения
Тема. Порядок реакции. Период полупревращения.
Мотивация изучения темы. Химическая кинетика является разделом физической химии, занимающимся изучением скорости и механизмом протекания реакций. На основе исследований строят гипотетическую схему, позволяющую объяснить всю совокупность известных экспериментальных фактов и позволяющую целенаправленно влиять на ту или иную химическую реакцию, осуществлять производственный синтез химических веществ.
Большое значение имеет кинетика и для фармации. Действие различных лекарственных веществ обуславливается в значительной степени скоростью реакций, происходящих в организме. При хранении лекарственных форм могут протекать различные реакции, скорость которых определяет срок годности лекарств.
В фармации используются фармакокинетика и фармакодинамика.
Фармакокинетика изучает распределение во времени фармакологически активных веществ и их метаболитов (продуктов их превращений) в различных частях живого организма (например, в волосах, слюне, в крови, в печени и в других внутренних органах). В отличии от биохимии фармакокинетика не занимается механизмами превращения инородных веществ (в частности лекарственных препаратов).
Фармакодинамика изучает действие во времени на живой организм различных фармакологически активных веществ.
Цель. Приобрести навыки определения кинетических характеристик реакций.
— научиться описывать протекание химических превращений во времени с помощью кинетических уравнений; — уметь характеризовать экспериментальные методы изучения протекания реакций во времени; — научиться описывать с помощью кинетических кривых и кинетических уравнений изменение во времени количества лекарства в организме; — научиться по известному уравнению кинетики реакции время полупревращения выразить через константу скорости.
Продолжительность занятия — 100 мин. (90 мин. учебного времени и 10 мин. перерыв). Место проведения занятие — учебный практикум (кафедра общей химии).
Задания для самостоятельной работы студента во внеучебное время (самоподготовка).
А. Контрольные вопросы.
Простые и сложные реакции по механизму. Скорость химической реакции. Молекулярность и порядок реакции. Классификация реакций по порядку и молекулярности. Уравнения кинетики реакций. Количественная характеристика протекания реакций во времени — время полупревращения (время полураспада) реагента.
Б. Список рекомендуемой литературы.
Общая химия. Биофизическая химия. Химия биогенных элементов. Учебник для ВУЗов. , , и др. — 2 изд. — М, ВШ, 2002. Практикум по общей химии. Физическая химия. Химия биогенных элементов под ред. , . — М, В/П, 2006.
, , Филиппова задач и упражнений по общей химии. — М, ВШ, 2007. , , СЮ. Быликин. Биофизическая и бионеорганическая химия. Медицинское информационное агентство (МИА), М., 2008. Текст лекций.
В. Обучающий материал.
Химическая кинетика изучает скорости химических реакций, их зависимость от различных факторов и механизмы реакций. Последовательность и характер стадий химических реакций называют механизмом реакции.
По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Под элементарным актом понимают единичный акт взаимодействия или превращения частиц, в результате которого образуются новые частицы продуктов реакции или промежуточных соединений; В элементарном акте принимает участие одна или две частицы (реже три).
Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Различают следующие типы сложных реакций: параллельные, последовательные, сопряженные, цепные.
Скорость химической реакции (V) определяется изменением концентрации ДС реагирующих веществ (или продуктов реакции) в единицу времени. Размерность скорости химической реакции — концентрация/время. Единица измерения [моль/(л-с)]. В химической кинетике
пользуются понятием средней скорости в данном интервале времени Дt:
Истинная скорость (в любой момент времени) определяется первой производной концентрации во времени 
Скорость химической реакции зависит в первую очередь от природы реагирующих веществ. Скорость гомогенной реакции зависит от концентрации реагентов, а гомогенных — от площади соприкасающихся фаз, т. е. от степени дисперсности. Скорости всех реакций зависят от температуры, многих реакций — от присутствия катализаторов.
Зависимость скорости химической реакции от концентрации описывается кинетическим уравнением. Например, для реакции: аА + bВ ⇄ продукты; V = KCp(A)Cq(B), где р, q — эмпирические (найденные экспериментальным путем) коэффициенты, не обязательно совпадающие со стехиометрическими коэффициентами а и b; k — константа скорости реакции, размерность которой зависит от значений р и q.
Константа скорости зависит от тех лее факторов, что и скорость химической реакции, но не зависит от концентрации реагирующих веществ.
Величина p+q определяет порядок кинетического уравнения реакции, который показывает, каким образом скорость реакции зависит от концентрации реагентов. Порядок кинетического уравнения может принимать значения 0, 1, 2 и более, он может быть также дробным.
Важной характеристикой реакции является период полупревращения t0,5 — время, за которое в реакцию вступает половина исходного вещества. Для радионуклидов аналогичная величина называется периодом полураспада.
Кинетические расчеты позволяют ответить на следующие вопросы:
1) сколько времени требуется для уменьшения концентрации исходного вещества до заданного уровня? (так, например, можно определить оптимальные промежутки времени между приемами лекарственного средства);
2) какой будет концентрация исходного вещества по истечении заданного промежутка времени? (так оценивается, например, остаточное количество токсиканта).
Для решения этих вопросов используют кинетические уравнения. Обозначим через с0 начальную концентрацию реагента, через с — концентрацию реагента в момент времени t; (с0 — с) — концентрацию веществ в данный момент времени. Для реакций нулевого порядка:
V = к, 

Период полупревращения реакций нулевого порядка прямо пропорционален исходной концентрации вещества. Единица измерения к — моль ∙ л-1 ∙ с-1
Примерами реакций нулевого порядка являются фотохимические, ферментативные и
когда реагирующее вещество взято в большом избытке или убыль его постоянно восполняется.
Для реакций первого порядка: V = кс;,
Отсюда 

Или 
Период полупревращения для реакции первого порядка (подставили в уравнение (1)
вместо С концентрацию со/2):
Период полупревращения для реакции первого порядка не зависит от концентрации исходного вещества. К реакциям первого порядка относят большинство реакций гидролиза органических соединений, процессы выведения лекарственного препарата из организма, разложение лекарственных препаратов при хранении, реакции радиоактивного распада.
Для реакции второго порядка: V = kc1c2. Если концентрации реагирующих веществ равны, то V=kc2. 


Откуда 
Если исходные концентрации реагирующих веществ, вступивших в реакцию, разные, то
Соа и Сов и сА и Св — концентрации (соответственно) исходные вещества А и В, и концентра-
ции по истечении времени. Период полупревращения
Период полупревращения для реакции второго порядка обратно пропорционален начальной концентрации реагирующих веществ.
Кинетике второго порядка подчиняются такие простые бимолекулярные реакции, как, например, щелочной гидролиз сложного эфира.
Из приведенных уравнений можно сделать следующие выводы:
величина константы скорости уравнения первого порядка не зависит от способа выражения концентрации, а констант нулевого и второго порядков зависит. Например, если концентрацию выразить не в моль на л, а в миллимоль на литр, то величина константы скорости кинетических уравнений реакции нулевого порядка увеличится в 1000 раз, а величина константы скорости кинетических уравнений реакций второго порядка в 1000 раз уменьшится; величины констант скорости кинетических уравнений реакций всех порядков зависят от выбранной единицы времени. Например, если время выразить не в секундах, а в минутах, то величины констант возрастут в 60 раз; период полупревращения реакций первого порядка не зависит от начальной концентрации реагента, период полупревращения реакций нулевого порядка возрастает при увеличении с0, а реакций второго порядка уменьшается. Анализируя зависимость периода полупревращения реакции от начальной концентрации реагента, можно определить порядок реакции.
http://megaobuchalka.ru/1/943.html
http://pandia.ru/text/80/496/33277.php