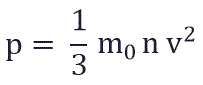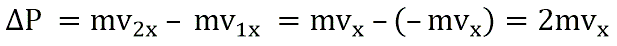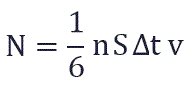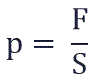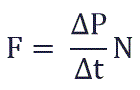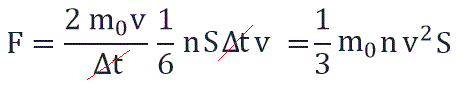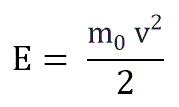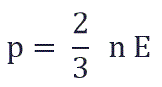Основное уравнение молекулярно-кинетической теории (МКТ) с выводом
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
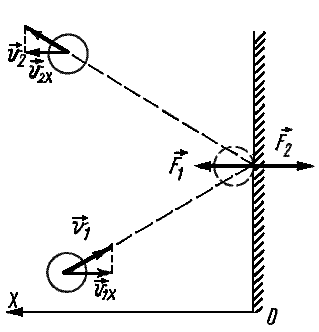
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Вывод основного уравнения мкт идеального газа 10 класс
«Физика — 10 класс»
Строгий вывод уравнения молекулярно-кинетической теории газов довольно сложен.
Поэтому мы ограничимся упрощённым выводом уравнения.
Предположим, что газ идеальный и взаимодействие молекул со стенкой абсолютно упругое.
Вычислим давление газа, находящегося в сосуде, на боковую стенку площадью S, перпендикулярную координатной оси ОХ (рис. 9.2).
Уравнение молекулярно-кинетической теории — первое количественное соотношение, полученное в МКТ, поэтому оно называется основным.
После вывода этого уравнения в XIX в. и экспериментального доказательства его справедливости началось быстрое развитие количественной теории, продолжающееся по сегодняшний день.
При ударе молекулы о стенку её импульс изменяется: Δрх = m0(υх — υ0x).
При абсолютно упругом взаимодействии модули скорости молекулы до и после удара равны, и тогда изменение импульса Δрх = 2m0υx.
Согласно второму закону Ньютона изменение импульса молекулы равно импульсу подействовавшей на неё силы со стороны стенки сосуда, а согласно третьему закону Ньютона импульс силы, с которой молекула подействовала на стенку, будет иметь то же значение.
Следовательно, в результате удара молекулы на стенку подействовала сила, импульс которой равен 2m0|υx|.
Молекул много, и каждая из них передаёт стенке при столкновении такой же импульс.
За время t они передадут стенке импульс 2m0|υx|Z, где Z — число ударов всех молекул о стенку за это время.
Число Z, очевидно, прямо пропорционально концентрации молекул, т. е. числу молекул в единице объёма, а также скорости молекул |υx|.
Чем больше эта скорость, тем больше молекул за время t успеют столкнуться со стенкой.
Если бы молекулы «стояли на месте», то столкновений их со стенкой не было бы совсем.
Кроме того, число столкновений молекул со стенкой пропорционально площади S поверхности стенки: Z
Надо ещё учесть, что в среднем только половина всех молекул движется к стенке.
Благодаря хаотичному движению направления движения молекул по и против оси ОХ равновероятны, поэтому вторая половина молекул движется в обратную сторону.
Значит, число ударов молекул о стенку за время t 
Учтём, что не все молекулы имеют одно и то же значение квадрата скорости υ 2 x.
В действительности средняя сила, действующая на стенку, пропорциональна не υ 2 x, а среднему значению квадрата скорости 
Так как согласно формуле (9.5) 
Таким образом, давление газа на стенку сосуда равно:
Уравнение (9.6) и есть основное уравнение молекулярно-кинетической теории газов.
Формула (9.6) связывает макроскопическую величину — давление, которое может быть измерено манометром, — с микроскопическими параметрами, характеризующими молекулы: их массой, концентрацией, скоростью хаотичного движения.
Связь давления со средней кинетической энергией молекул.
Если через 

Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул.
Источник: «Физика — 10 класс», 2014, учебник Мякишев, Буховцев, Сотский
Основные положения МКТ. Тепловые явления — Физика, учебник для 10 класса — Класс!ная физика
Урок физики в 10 классе «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ »
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
ТЕМА «ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ » 10 КЛАСС
Обучающие: познакомить с понятием идеального газа, вывести основное уравнение молекулярно-кинетической теории газов.
· развивать способности анализировать увиденное, логическое мышление и творческое воображение учащихся;
· учить устанавливать причинно-следственные связи в изучаемых явлениях, формулировать эмпирические закономерности.
Воспитывающие : воспитывать ответственное отношение к учебе, положительное отношение к предмету физики.
· воздушный насос, вакуумная тарелка, стеклянный колокол, воздушный шарик
· карточки с тестом
I . Повторение пройденного. Беседа с учащимися с использованием презентации (Приложение 1)
- Каковы основные положения молекулярно-кинетической теории строения вещества? (слайд 2)
- Докажите, что все вещества состоят из молекул, между которыми есть промежутки? (слайд 3)
- В чем суть броуновского движения? Доказательством каких положений является броуновское движение? (слайд 4)
- Что такое диффузия? Доказательством каких положений является броуновское движение? (слайд 5)
- Зависит ли скорость диффузии от температуры? (слайд 6)
- О чем говорят опыты, показанные на слайде № 7
- Каковы размеры молекул? (слайд 8)
- Опишите словами модель взаимодействия между молекулами или атомами твердого тела. (слайд 9)
- В каком агрегатном состоянии находится вещество, показанное на слайдах № 10,11,12? Укажите особенности расположения и движения молекул в различных агрегатных состояниях.
II . Изучение нового материала
Итак, мы знаем, что частицы в газах, в отличие от жидкостей и твердых тел, располагаются друг относительно друга на расстояниях, существенно превышающих их собственные размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше энергии межмолекулярного взаимодействия. Для выяснения наиболее общих свойств, присущих всем газам, используют упрощенную модель газа — идеальный газ.
Идеальный газ – это газ, у которого взаимодействие между молекулами пренебрежимо мало (слайд13) (записываем в тетрадь)
Основные отличия идеального газа от реального газа:
1. Частицы идеального газа — сферические тела очень малых размеров, практически материальные точки.
2. Между частицами отсутствуют силы межмолекулярного взаимодействия.
3. Соударения частиц являются абсолютно упругими.
Реальные разреженные газы действительно ведут себя подобно идеальному газу. Воспользуемся моделью идеального газа для объяснения происхождения давления газа.
Вспомним опыт из 7 класса (слайд14)
Почему при откачивании воздуха из-под колокола воздушный шарик раздувается?
(Это значит, что газ внутри шарика оказывает давление, и когда внешнее давление при откачивании уменьшается, шар благодаря внутреннему давлению воздуха начинает раздуваться?
Что же такое давление газа? (слайд15)
(Давление газа — это результат ударов молекул газа о стенки сосуда)
Сегодня мы с вами попытаемся ответить, от чего зависит давление газа? (Слайд 16)
Даю возможность учащимся сделать предположения, от чего может зависеть давление газа.
Выведем основное уравнение молекулярно-кинетической теории газов (слайд 17)
Пусть в некотором объеме есть молекулы, масса каждой mo , их число равно N , и движутся они со скоростью v (очевидно, что скорости у всех молекул различны, однако среднее значение модуля скорости v вполне определенное)
Учитель делает рисунок на доске, учащиеся в тетрадях
При каждом ударе молекулы действуют на стенку сосуда с некоторой силой. Складываясь друг с другом, силы ударов отдельных частиц образуют некоторую силу давления, постоянно действующую на стенку, а значит и давление.
От чего же зависит давление газа?
Во-первых , от массы: чем больше масса молекулы, тем сильнее удар, значит здесь прямая пропорциональная зависимость давления от массы
1) р 
Во-вторых , от скорости: чем быстрее движутся молекулы, тем сильнее будут удары, а значит и давление.
2) р 
В-третьих, есть еще одна зависимость от скорости: чем быстрее движутся молекулы, тем чаще удары, а значит и давление.
3) р 
В-четвертых , давление газа зависит от числа молекул в данном сосуде, а точнее от концентрации n .
Концентрация – физическая величина, равная числу молекул, содержащихся в единице объема ( n = N / V )
( определение концентрации и единицы измерения записываем в тетрадь )
4) р 
В результате получаем: давление газа прямо пропорционально концентрации частиц, массе частицы и квадрату скорости частицы
Это и есть основное уравнение молекулярно-кинетической теории идеального газа. В этом уравнении коэффициент 1/3 означает, что в трехмерном пространстве только треть молекул участвует в движении в определенном направлении (по оси х, например).
Мы получили основное уравнение МКТ идеального газа из общих соображений, но его можно строго вывести, опираясь на законы классической механики ( § 63 , Мякишев Г.Я.)
Это уравнение можно записать по-другому, если умножить и разделить правую часть уравнения на 2.
Давление идеального газа пропорционально произведению концентрации молекул и средней кинетической энергии поступательного движения молекул
III . Закрепление изученного материала. Выполнение тестов учащимися.
Цель заданий: определить степень усвоения нового материала
1. Давление газа на стенку сосуда обусловлено
А. притяжением молекул друг к другу
Б. столкновениями молекул со стенками сосудов
В. столкновением молекул газа между собой
Г. проникновением молекул сквозь стенки сосуда
2. Как изменилось давление идеального газа, если в данном объеме скорость каждой молекулы газа увеличилась в 2 раза, а концентрация молекул осталась без изменения?
А. увеличилось в 2 раза
Б. увеличилось в 4 раза
В. уменьшилось в 2 раза
Г. уменьшилось в 4 раза
3. При повышении температуры идеального газа в запаянном сосуде его давление увеличивается. Это объясняется тем, что с ростом температуры.
А.увеличиваются размеры молекул газа
Б. увеличивается энергия движения молекул газа
В. увеличивается потенциальная энергия молекул газа
Г. увеличивается хаотичность движения молекул газа
4. Как изменится концентрация молекул газа при уменьшении объема сосуда в 2 раза?
А.увеличится в 2 раза
Б. уменьшится в 2 раза
Г. уменьшится в 4 раза
5. При уменьшении температуры средняя кинетическая энергия молекул
Г. иногда увеличится, иногда уменьшится
6. Какое утверждение неправильно?
При неизменных условиях
А. давление газа постоянно
Б. скорости всех молекул одинаковы
В. внутренняя энергия газа постоянна
Г. температура газа постоянна
7. В сосуде водород. Как изменится давление газа, если водород заменить кислородом так, что количество молекул и температура останутся неизменными?
А.увеличится в 4 раза
Б. уменьшится в 16 раз
Г. увеличится в 16 раз
IV . Проверка выполненных тестов
Правильные ответы: 1 — Б, 2 – Б, 3 – Б, 4 – А, 5 – Б, 6 – Б , 7 — Г
V . Решение задачи
В ампуле содержится водород (Н 2 ). Определите давление газа, если его концентрация равна 2 · 10 22 м -3 , а средняя квадратичная скорость движения молекул водорода 500 м/с.
VI . Задание на дом.
§ 61, § 63, Физика 10 класс Г.Я. Мякишев, Б.Б Буховцев, записи в тетради, упр. 11 (задачи 8,9)
VII . Подведение итогов урока.
1. Физика. 10 класс: учебник для общеобразовательных учреждений: базовый и профильный уровни /Г.Я Мякишев, Б.Б.Буховцев, Н.Н. Сотский; — М.: Просвещение, 2009.
2. Физика. Тесты. 10-11 классы: учебно-методическое пособие / Н.К. Гладышева, И.И. Нурминский, А.И. Нурминский и др. – М.: Дрофа, 2005.
http://class-fizika.ru/10_a211.html
http://infourok.ru/urok-fiziki-v-10-klasse-osnovnoe-uravnenie-molekulyarno-kineticheskoj-teorii-gazov-5162901.html