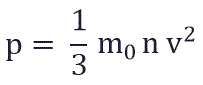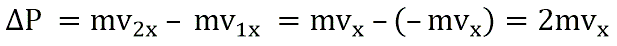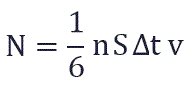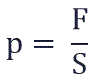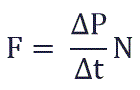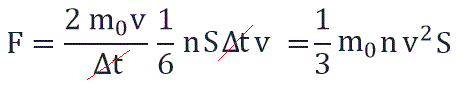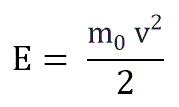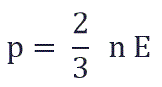Основное уравнение молекулярно-кинетической теории (МКТ) с выводом
В статье рассмотрена модель идеального газа, приведено основное уравнение молекулярно-кинетической теории и его вывод.
Чтобы объяснить свойства материи в газообразном состоянии, в физике применяется модель идеального газа. Идеальный газ — разреженный, состоящий из одного типа атомов газ, частицы которого не взаимодействуют между собой. Помимо основных положений МКТ эта модель предполагает, что:
- молекулы имеют пренебрежимо малый объем в сравнении с объемом емкости
- при сближении частиц друг с другом и с границами емкости имеют место силы отталкивания
Основное уравнение молекулярно-кинетической теории
Физический смысл основного уравнения МКТ заключается в том, что давление идеального газа — это совокупность всех ударов молекул о стенки сосуда. Это уравнение можно выразить через концентрацию частиц, их среднюю скорость и массу одной частицы:
p – давление молекул газа на границы емкости,
m0 – масса одной молекулы,
n — концентрация молекул, число частиц N в единице объема V;
v 2 — средне квадратичная скорость молекул.
Вывод основного уравнения МКТ
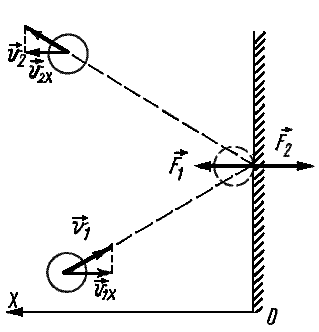
Частицы идеального газа при соударениях с границами емкости ведут себя как упругие тела. Такое взаимодействие описывается согласно законам механики. При соприкосновении частицы с границей емкости проекция vx скоростного вектора на ось ОХ, проходящую под прямым углом к границе сосуда, меняет свой знак на противоположный, но сохраняется неизменной по модулю:
Поэтому после соударения частицы с границей емкости проекция импульса молекулы на ось ОХ меняется с mv1x = –mvx на mv2x = mvx.
Изменение импульса молекулы ΔP равняется удвоенному произведению массы молекулы на ее скорость:
Поскольку в каждом из шести основных направлений декартовой системы координат (вверх, вниз, вперед, назад, вправо, влево) движется одна шестая часть частиц N/6. Тогда число частиц, которые сталкиваются с каждой стенкой за время Δt равно:
S – площадь этой стенки
n — концентрация частиц
Давление p равно отношению силы F к площади S, на которую действует эта сила:
Суммарная сила, с которой частицы давят на стенку равна отношению произведения числа этих частиц N и изменения импульса ΔP ко времени, в течение которого происходит давление:
Исходя из вышенаписанного получаем:
Если заменить среднее значение кинетической энергии поступательного движения молекул — E:
и подставить эту формулу в основное уравнение МКТ, получим давление идеального газа:
Давление идеального газа равняется двум третям средней кинетической энергии поступательного движения молекул на единицу объема. При решении задач реальный газ можно считать идеальным газом, если он одноатомный и можно пренебречь взаимодействием между частицами.
Понравилась статья, расскажите о ней друзьям:
Вывод основного уравнения молекулярной теории газов
9.1. Модель идеального газа в молекулярно-кинетической теории
Законы идеальных газов, найденные опытным путём, находят довольно простое объяснение в молекулярно-кинетической теории (МКТ). Она исходит при этом из упрощённых представлений о строении газа. Это обусловлено рядом причин, в частности, неточным знанием сил взаимодействия между молекулами. Однако, как оказывается, даже такая упрощённая модель газа позволяет найти уравнение состояния, правильно описывающее его поведение.
В молекулярно-кинетической теории принимается следующая идеализированная модель газа – идеальный газ. Молекулы газа считаются твёрдыми, абсолютно упругими шариками, причём размеры молекул малы по сравнению со средним расстоянием между ними. Это означает, что собственный суммарный объём молекул значительно меньше объёма сосуда, в котором находится газ. Взаимодействие между молекулами проявляется только при непосредственном столкновении их друг с другом. Между столкновениями молекулы движутся по инерции. Движение молекул подчиняется законам механики Ньютона.
Для нахождения уравнения состояния газа необходимо сделать ещё важное упрощающее предположение, а именно, считать движение любой молекулы газа беспорядочным, хаотичным.
Аккуратный вывод основного уравнения молекулярно-кинетической теории идеального газа требует принимать во внимание ряд моментов, например, наличие в газе молекул, движущихся с разными по величине скоростями, столкновения молекул между собой, характер столкновения отдельной молекулы со стенкой сосуда (упругий или неупругий). В разделе 7.3 будет рассмотрен упрощённый вариант вывода основного уравнения молекулярно-кинетической теории.
9.2. Давление идеального газа
Давление, которое оказывает газ на стенку сосуда, есть результат ударов молекул газа о стенку. Если бы в сосуде содержалось всего несколько молекул, то их удары следовали бы друг за другом редко и беспорядочно. Поэтому нельзя было бы говорить ни о какой регулярной силе давления, действующей на стенку. Стенка подвергалась бы отдельным практически мгновенным бесконечно малым толчкам. Если же число молекул в сосуде очень велико, то велико и число ударов их о стенку сосуда. Одновременно о стенку сосуда ударяется громадное количество молекул. Очень слабые силы отдельных ударов складываются при этом в значительную по величине и почти постоянную силу, действующую на стенку. Среднее по времени значение этой силы, отнесённое к единичной площадке, и есть давление газа, с которым имеет дело термодинамика.
Пусть в сосуде объёма $$ V$$ находятся $$ N$$ одинаковых молекул идеального газа, а $$
Вывод основного уравнения молекулярной теории газов
271 дн. с момента
до конца учебного года
Основное уравнение МКТ
Слово «газ» в переводе с греческого звучит как «хаос». Это отлично характеризует движение частичек, которое на самом деле беспорядочно и хаотично. Газ не образует определенной поверхности, он заполняет весь доступный ему объем. Такое состояние веществ — самое распространенное в нашей Вселенной.
Законы, которые определяют свойства и поведение такого вещества, легче всего формулировать и рассматривать на примере состояния, в котором относительная плотность молекул и атомов низкая. Оно получило название «идеальный газ». В нем расстояние между частицами больше, чем радиус взаимодействия межмолекулярных сил.
Итак, идеальный газ — это теоретическая модель вещества, в которой почти полностью отсутствует взаимодействие частиц.
Как показывает опыт, молекулы газа распределяются по всему предоставленному для него объему. Следовательно, главную роль в поведении газа играет хаотическое движение молекул, а силы взаимодействия малы, и ими можно пренебречь. Это означает, что молекула газа движется равномерно и прямолинейно, пока не столкнется с другой молекулой. При столкновении изменяется величина и направление скорости движения молекулы, и она снова движется равномерно и прямолинейно до следующего столкновения. Дли на свободного пробега (расстояние между двумя последовательными столкновениями молекулы) λ
10 -7 м. При такой длине свободного пробега только 0,04 % пространства, занятого газом, приходится на собственный объем его молекул. Это дает право воспользоваться моделью идеального газа.
Идеальный газ — это газ с достаточно простыми свойствами:
- Между частицами идеального газа нет сил взаимодействия; они действуют только при столкновениях частиц (т.е. потенциальная энергия взаимодействия частиц идеального газа настолько мала, что ею пренебрегают по сравнению с кинетической энергией);
- Частицы в идеальном газе имеют настолько маленькие размеры, что их можно считать материальными точками. Их суммарный объём ничтожно мал по сравнению с объёмом сосуда, в котором находится газ. И этим объёмом пренебрегают;
- От столкновения до столкновения частицы движутся равномерно и прямолинейно;
- Движение частиц идеального газа подчиняется законам Ньютона;
- Частицы идеального газа ведут себя при столкновениях как абсолютно упругие шарики;
- Среднее время между столкновениями частиц намного превышает время их взаимодействия при соударении. Поэтому временем взаимодействия пренебрегают также.
При небольших давлениях и не очень низких температурах реальные газы близки к идеальному газу. При высоких давлениях молекулы газа находятся так близко, что между ними возникают заметные силы взаимодействия. Пренебречь их собственным объемом нельзя, и газ уже не является идеальным.
Реальные газы при комнатной температуре и нормальном давлении ведут себя как идеальные газы. Идеальными газами можно считать такие газы как гелий, водород, свойства которых уже при обычных условиях отвечают закономерностям идеального газа.
Для описания свойств газов можно пользоваться:
- микроскопическими параметрами (скорость, масса молекулы, ее энергия и др.), которые являются характеристиками молекул и средние численные значения которых находятся только расчетным путем;
- макроскопическими параметрами (давление, температура, объем газа), значение которых определяется совместным действием огромного числа молекул. Макропараметры — это параметры, характеризующие состояние системы (газа) в целом и не имеющие смысла в применении к отдельным частицам системы. Численные значения их находят измерением с помощью приборов и расчетным путем.
Давление газа p — это средняя сила ударов его молекул о тело (например, о стенки сосуда), отнесенная к единице поверхности тела.
Абсолютная температура T — мера средней кинетической энергии теплового движения молекулы (см. Температура и тепловое равновесие системы).
Под объемом газа V понимают внутренний объем сосуда, в котором находится газ.
P =1/3 monV 2 — основное уравнение МКТ идеального газа. Выведено в предположении, что давление газа есть результат ударов его частиц о стенки сосуда.
http://zftsh.online/articles/4933
http://www.sites.google.com/site/opatpofizike/osnovnoe-uravnenie-mkt