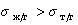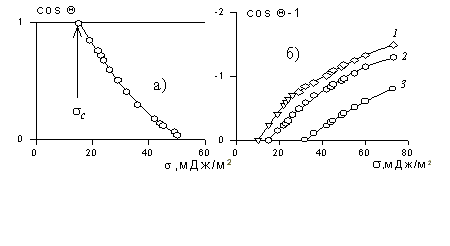Лекция №4
План лекции:
МЕЖФАЗНЫЕ ВЗАИМОДЕЙСТВИЯ МЕЖДУ КОНДЕНСИРОВАННЫМИ ФАЗАМИ
К межфазным взаимодействиям между конденсированными фазами относятся смачивание, растекание и адгезия.
Как правило, адгезия и смачивание сопровождают друг друга. Эти явления широко распространены в природе и в различных отраслях промышленности (нанесение лакокрасочных покрытий, получение материалов на основе связующих и наполнителей — бетон, резина и т. д.)
АДГЕЗИЯ
Адгезия — межфазное взаимодействие, или взаимодействие между приведёнными в контакт поверхностями конденсированных тел разной природы (прилипание). Адгезия обеспечивает между двумя телами соединение определенной прочности, обусловленное межмолекулярными силами.
Адгезия между — ж/ж, ж/т, т/т.
Адгезия — результат стремления системы к уменьшению поверхностной энергии, поэтому это самопроизвольный процесс. Работа адгезии Wa, характеризующая прочность адгезионной связи, определяется работой обратного разрыва адгезионной связи, отнесённой к единице площади:
W s = WаS, где Ws — полная работа адгезии (4.1)
Cоотношение между Wa и s :
Предположим, что имеется контакт между 3 фазами — 1 — газ, 2 -жидкость, 3 — твердое тело, 2, 3 — конденсированные фазы. Введем следующие обозначения поверхностных натяжений:
s 2,3 — поверхностное натяжение на границе раздела двух конденсированных фаз
s 2,1 и s 3,1 — поверхностное натяжение на границе с воздухом
Уравнение Дюпре отражает закон сохранения энергии при адгезии. Из него следует, что работа адгезии тем больше, чем больше поверхностные натяжения исходных компонентов и чем меньше конечное межфазное натяжение.
Уравнение 4.2 справедливо только для изобарно-изотермического процесса в отсутствии электрического и химического взаимодействия между контактирующими телами, его используют только для определения равновесной работы адгезии жидкости.
Равновесную работу адгезии можно сопоставить с равновесной работой когезии. Когезия — определяет связь между молекулами внутри тела и в пределах одной фазы, характеризует прочность конденсированных тел и их способность противодействовать внешнему усилию.
Механизм адгезии
Первая стадия — транспортная, перемещение адгезива (клеящего вещества) к поверхности субстрата (тело, на которое наносят адгезив) и их определенное ориентирование в межфазном слое.
Вторая стадия — взаимодействие адгезива и субстрата, обусловлено различными силами (от ван-дер-ваальсовых до химических).
Завершается процесс адгезии межмолекулярным взаимодействием контактирующих фаз, что соответствует минимальной поверхностной энергии. Различают несколько механизмов (и, соответственно, теорий) в зависимости от природы взаимодействующих тел и условий, при которых происходит адгезия.
1.Механическая адгезия — осуществляется путем затекания в поры и трещины поверхности твердого тела жидкого адгезива., который потом затвердевает, обеспечивая механическое зацепление.
2.Молекулярная (адсорбционная) адгезия — возникает под действием межмолекулярных ван-дер-ваальсовых сил и водородных связей.
3.Электрическая теория — связана с образованием ДЭС на границе раздела между адгезивом и субстратом.
4.Диффузионный механизм — предусматривает взаимное проникновение молекул и атомов в поверхностные слои взаимодействующих фаз.
Чаще всего механизм адгезии является смешанным.
Теоретическая оценка адгезии очень приближённа, т. е., механизм её недостаточно изучен.
СМАЧИВАНИЕ
Смачивание — это поверхностное явление, заключающееся во взаимодействии жидкости с твёрдым или другим жидким телом при наличии контакта трех несмачивающихся фаз, одна из которых воздух.
Степень смачивания количественно характеризуется косинусом краевого угла (угла смачивания) или просто краевым углом (углом смачивания).
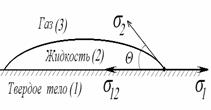
Рис.4.2. К выводу уравнения для краевого угла (закон Юнга).
Рис.4.2. иллюстрирует состояние капли жидкости на поверхности твердого тела в условиях равновесия. Поверхностная энергия твердого тела, стремясь уменьшиться, вызывает растяжение капли по поверхности. Эта энергия равна поверхностному натяжению твердого тела на границе с воздухом s 3,1 .Межфазная энергия на границе твердого тела с жидкостью s 2,3 стремится сжать каплю. Растеканию препятствуют когезионные силы, действующие внутри капли. Действие когезионных сил направлено от границы между твердой, жидкой и газообразной фазами по касательной к сферической поверхности капли и равно s 2,1 .Угол q — краевой угол или угол смачивания.
Чем меньше краевой угол , тем лучше смачивание поверхности.
Если cos( q )>0 , то поверхность хорошо смачиваемая, cos( q )
Если разность s 3,1 — s 2,3 в уравнении Дюпре заменить её выражением из закона Юнга, то
Wa/ s 2,1 = 1+ cos( q ) — уравнение Дюпре-Юнга (4.5)
4.3, 4.4, 4.5 — только для идеально гладких тел. На поверхности реальных тел есть поры, трещины, и т. д.
Рассмотрим кинетический катерезис, который замедляет достижение равновесной формы капли.
Рис.4.3.Статические углы натекания и оттекания.
Для реальных тел: равновесный угол смачивания равен полусумме предельных углов натекания и оттекания:
cos( q ) = (cos( q нт ) + сos( q от ))/2 (4.6)
Влияние шероховатости на кривой угол:
k = cos( q ш )/cos( q ) , где к — коэфф. шероховатости
При повышении степени шероховатости смачиваемость улучшается.
РАСТЕКАНИЕ
Капля жидкости, нанесенная на поверхность, может оставаться на ее определенном участке, и система будет находится в равновесии в соответствии с законом Юнга, или же растекаться по поверхности. В обоих случаях система переходит в состояние с минимальной энергией Гиббса.
Из этого соотношения следует, что уменьшение межфазного натяжения s 2,3 (увеличение работы адгезии) и поверхностного натяжения жидкости s 2,1 , способствует растеканию жидкости.
Растекание происходит в том случае, если работа адгезии превышает работу когезии.
Способность жидкости растекаться зависит от когезии наносимых на поверхность жидкостей.
С повышением температуры увеличивается работа адгезии, поэтому нерастекающаяся жидкость с увеличением температуры может начать растекаться.
Поверхностные явления и адсорбция
Кандидат химических наук, доцент
Тема 1. Поверхностные явления и адсорбция
Занятие 2. Поверхностные явления
2. Смачивание и растекание.
3. Основные понятия и характеристики адсорбции.
4. Изотермы и изобары адсорбции
ЛИТЕРАТУРА
1. Фролов коллоидной химии. – М.: Химия, 1989. – С. 25-31, 78-96.
2. Коллоидная химия. – СПб.: «Лань», 2003. – С. 70-76.
НАГЛЯДНЫЕ ПОСОБИЯ И ПРИЛОЖЕНИЯ
Работа когезии и адгезии
Краевой угол смачивания
Критерии смачивания и несмачивания
ВВЕДЕНИЕ
Изучение поведения жидкостей на твердых и жидких поверхностях представляет большой интерес в связи с широкой распространенностью явлений смачивания и растекания как в природе, так и в различных отраслях народного хозяйства. Явления смачивания и растекания лежат в основе процессов отмывания жидких загрязнений с твердых покрытий. Начнем с изучения понятий адгезии и когезии.
1. АДГЕЗИЯ И КОГЕЗИЯ
Когезия характеризует взаимное притяжение частиц (атомов, молекул) однородного тела, обусловленное силами межмолекулярного взаимодейст-вия, действующими внутри тела.
Когезия характеризует прочность тел на разрыв. Она сильна в твердых телах, меньше в жидкостях.
Адгезия характеризует взаимное притяжение частиц различных тел в области их соприкосновения (т. е. на поверхности раздела фаз), обусловленное силами межмолекулярного взаимодействия, действующими между этими телами.
Количественно когезия и адгезия характеризуются соответственно работой когезии Wк и работой адгезии Wa. Эти величины измеряются в тех же единицах, что и поверхностное натяжение (Дж/м2, Н/м), и они связаны с поверхностным натяжением (рис. 1).
Работа когезии Wк – работа, которую надо совершить для разрыва однородного тела по сечению с единичной площадью на две части. Эта работа затрачивается на разрыв межмолекулярных связей внутри тела. Представим мысленно цилиндр из какой-либо жидкости с единичной площадью сечения S (рис. 1). Разорвем этот цилиндр на 2 части.
 |
Рис. 1. К выводу соотношения между когезией и
Образовалась новая поверхность площадью 2S на границе жидкость – газ. Если вспомнить физический смысл поверхностного натяжения (это работа, которую надо совершить, чтобы увеличить на единицу площадь поверхности раздела фаз), то можно записать
где Wк – работа когезии, Дж/м2;
sЖ-Г – поверхностное натяжение на границе раздела
жидкость – газ, Дж/м2.
При разрыве твердого тела на две части работа когезии соответственно равна
где sТ-Г – поверхностное натяжение на границе раздела
твердое тело – газ, Дж/м2.
сразу можно отметить, что работа когезии тем больше, чем больше величина поверхностного натяжения.
Работа адгезии Wa – работа, которую надо совершить для разрыва двух соприкасающихся тел с единичной площадью контакта. Эта работа затрачивается на разрыв межмолекулярных связей, возникающих на границе раздела фаз.
 |
Рис. 2. К выводу соотношения между адгезией и
Пусть в соприкосновении находятся две несмешивающиеся жидкости с единичной площадью контакта. Граница раздела фаз характеризуется поверхностным натяжением sЖ1- Ж2. После разрыва исчезла граница раздела фаз ж1-ж2, но появились две новые площади поверхности, которые характеризуются поверхностным натяжением sЖ1- Г и sЖ2 — Г.
Очевидно, что работу адгезии можно рассчитать по формуле
Wa = sЖ1- Г + sЖ2 — Г – sЖ1- Ж2 (3)
Это выражение называется уравнением Дюпре.
По аналогии при отрыве жидкости от твердой поверхности совершается работа адгезии, равная:
Wa = sЖ — Г + sТ — Г – sТ — Ж (4)
По уравнению (3) работу адгезии вычислить достаточно легко, поскольку все входящие в него величины определяются экспериментально.
По уравнению (4) рассчитать Wа практически невозможно, т. к. определение поверхностного натяжения на границе с твердым телом представляет собой сложную экспериментальную задачу.
Силы когезии и адгезии играют большую роль в процессах смачивания и несмачивания жидкостями твердых тел, склеивания материалов, нанесения лакокрасочных и других покрытий, печатания, крашения.
2. СМАЧИВАНИЕ И РАСТЕКАНИЕ
Смачивание – это поверхностное явление, заключающееся во взаимодействии жидкости с твердым или другим жидким телом при наличии одновременного контакта трех несмешивающихся фаз, одна из которых обычно является газом (воздухом).
При нанесении капли жидкости на поверхность твердого тела (или другой жидкости) можно наблюдать разные явления. В одном случае нанесенная жидкость сохраняет форму капли, в другом случае капля растекается по поверхности. Рассмотрим первый случай (рис. 3)
 |
Рис. 3. Смачивание жидкостью твердого тела
Линия соприкосновения трех фаз называется периметром смачивания. Угол q называется краевым углом смачивания. Он отсчитывается со стороны жидкости. Поскольку капля находится в состоянии равновесия, действие сил на нее скомпенсировано. Рассмотрим эти силы. Как известно, силы поверхностного натяжения направлены на сокращение площади контакта фаз и действуют по касательной к поверхности. На рис. 3 эти силы представлены векторами, выходящими из точки соприкосновения всех трех фаз.
sТ-Г – стремиться уменьшить площадь контакта твердого тела с газом, поэтому растягивает пленку жидкости по твердому телу.
sТ-Ж – стремится уменьшить площадь контакта твердого тела с жидкостью, поэтому стягивает каплю жидкости в шарик.
sЖ-Г – стремится уменьшить площадь контакта жидкости с газом, поэтому стягивает каплю жидкости в шарик (шарообразная поверхность имеет наименьшую площадь).
Рассмотрим равнодействующую сил, действующих на каплю в точке О вдоль поверхности твердого тела. Эти силы поверхностного натяжения sТ-Г, sТ-Ж, а также проекция sЖ-Г на выбранную ось 
В состоянии равновесия равнодействующая сил равна 0:
sТ-Г = sТ-Ж + sЖ-Г. cosq (5)
Полученное соотношение (5) называется законом Юнга.
Краевой угол смачивания q или cosq являются количественной характеристикой смачивания. Чем меньше угол q и соответственно больше cosq, тем лучше смачивается поверхность.
Закон Юнга позволяет выразить cosq через поверхностные межфазные натяжения:

Сочетание уравнения Дюпре (4) с законом Юнга (5) позволяет выразить работу адгезии Wa через косинус краевого угла смачивания q.
Из уравнения (5) выразим разность
sТ-Г – sТ-Ж = sЖ-Г. cosq
Полученную разность подставим в уравнение 4
Wa = sЖ-Г + sЖ-Г. cosq = sЖ-Г(1 + cosq) (7)
Уравнение (7) называют уравнением Дюпре – Юнга. Оно позволяет рассчитать работу адгезии, если известно поверхностное натяжение жидкости и краевой угол смачивания. Обе эти величины сравнительно легко определяются экспериментально: q определяют путем проектирования капли на экран (с помощью несложной установки) и измерения краевого угла на проекции капли. С помощью уравнения Дюпре – Юнга (7) легко найти соотношение между работой когезии смачивающей жидкости и работой адгезии между жидкостью и смачиваемым телом.
Краевой угол смачивания (или косинус краевого угла) является характеристикой способности жидкости смачивать твердую или жидкую поверхность. В таблице 1 представлены возможные случаи поведения жидкости на твердой или жидкой поверхности. Смачивание или несмачивание зависит от соотношения работы когезии и работы адгезии.
Таблица 1. Критерии смачивания, несмачивания и растекания
q > 900 (тупой угол)
Смачивание жидкостью поверхности
Капиллярное поднятие или опускание жидкостей связано с возникновением кривизны поверхности (выпуклый или вогнутый мениск). В свою очередь появление кривизны поверхности связано с процессами смачивания (q 900, выпуклый мениск) жидкостями стенок капилляров.
Растекание жидкостей по поверхности
Особо остановимся на предельном случае смачивания – растекании жидкости по поверхности, которое наблюдается при q = 00, когда работа адгезии равна работе когезии (Wa = Wк). Очевидно, что чем больше преобладает работа адгезии над работой когезии, тем лучше будет растекаться жидкость по поверхности. Величина
называется коэффициентом растекания или критерием Гаркинса.
Если f > 0 – жидкость растекается (Wa > Wк)
Изотермы полимолекулярной адсорбции (рис.7) характерны для адсорбции газов и паров на твердых адсорбентах. Изотерма вида а (s-образная изотерма) при невысоких давлениях напоминает изотерму мономолекулярной адсорбции (участок Р1), т. е. на поверхности образуется один слой молекул адсорбтива. При дальнейшем увеличении давление газа на первый слой может сесть второй, третий и т. д. слой молекул, происходит полимолекулярная адсорбция, поэтому адсорбция резко возрастает.
Первый слой молекул удерживается на адсорбенте силами взаимодействия адсорбент — адсорбтив, а второй, третий слои удерживаются силами притяжения между молекулами адсорбтива. Концентрирование адсорбтива на поверхности приводит к тому, что газ (пар) конденсируется и образуется жидкий слой конденсата на поверхности адсорбента.
 |
Рис.7. Изотермы полимолекулярной адсорбции
Рs – давление насыщенного пара
Изотермы адсорбции с капиллярной конденсацией (рис.8) характерны для газов (паров), адсорбирующихся на пористых адсорбентах. Эти изотермы сходны с изотермами полимолекулярной адсорбции, но имеют и некоторые отличия. Пористые адсорбенты имеют многочисленные поры, которые представляют из себя капилляры. При образовании полимолекулярного слоя на стенках пор возникает искривленная (вогнутая) поверхность раздела фаз жидкость – пар, давление насыщенного пара над которой меньше, чем над плоской поверхностью. Поэтому в пористых материалах пар конденсируется при более низких давлениях и конденсация идет до заполнения всех пор. Этот процесс заканчивается раньше, чем достигается давление насыщенного пара. Поэтому изотерма адсорбции выходит на предельное значение (все поры заполнены, адсорбция не идет).
Рис.8. Изотермы полимолекулярной адсорбции,
осложненной капиллярной конденсацией
Рs – давление насыщенного пара
Изобары и изопикны адсорбции
Изобарой адсорбции называется зависимость величины адсорбции газа (или пара) на твердом адсорбенте от температуры при постоянном парциальном давлении газа (пара) А = fр(Т)
Изопикной адсорбции называется зависимость величины адсорбции растворенного вещества от температуры при постоянной концентрации растворенного вещества А = fc(Т)
Процесс адсорбции экзотермичен и, следовательно, в соответствии с принципом Ле-Шателье с ростом температуры величина физической адсорбции уменьшается (рис.9). При повышении температуры колебания адсорбированных поверхностью частиц усиливаются, они отрываются от поверхности, равновесие сдвигается в сторону процесса десорбции.
 |
Рис.9. Изобара (Р = const) или изопикна (С = const) адсорбции.
Описание взаимодействия молекул адсорбтива и молекул адсорбента представляет собой весьма сложную и до сих пор до конца неразрешенную задачу. Рассмотрению некоторых теорий адсорбции будет посвящена следующая лекция.
Сегодня мы познакомились с основными видами поверхностных явлений: смачиванием, растеканием и адсорбцией. Следующая лекция будет посвящена подробному рассмотрению явлений адсорбции, которые играют значительную роль в природе, технологических процессах.
2.3.2. Смачивание и растекание на границе твердое тело – жидкость – газ
В большинстве случаев жидкость на поверхности твердого тела остается в виде капли, большей или меньшей толщины, контактирующей с твердым телом под определенным углом, который называется краевым углом смачивания и обозначается буквой Q (рис. 1.24). Растекание капли по поверхности прекратится при достижении равновесия, которое без учета сил тяжести может быть описано уравнением Юнга:

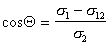
где индексы 1, 2, 3 – обозначают, соответственно, твердую, жидкую и газовую фазы.
Работа адгезии выражается уравнением Дюпре:
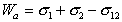
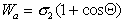
Рис. 1.24. Капля жидкости на поверхности твердого тела (схема)
Работа адгезии при 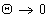
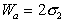
Следует помнить, что определение работы адгезии в реальных системах предполагает равновесие фаз, насыщенных относительно друг друга.
Кроме того, твердая поверхность, по которой происходит растекание жидкости, не свободна. Она обычно покрыта пленкой вещества, адсорбированного из газо-паровой фазы. Эта пленка имеет поверхностное давление p, поэтому
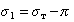
Смачивание неоднородных, пористых или шероховатых поверхностей сопровождается запиранием пузырьков воздуха в неровностях. В результате этого краевые углы смачивания сухой и предварительно увлажненной поверхностей различаются. Такое явление носит название «гистерезис смачивания». Гистерезис смачивания проявляется также при загрязнении поверхности, в результате чего она становится неоднородной при закреплении на ней твердых частиц или жировых пленок. В этом случае поверхность ведет себя как составная.
Шероховатость поверхности учитывается введением коэффициента шероховатости r, представляющего отношение площади поверхности реального тела к площади идеально гладкой поверхности, тогда
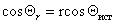
Можно отметить, что если краевой угол смачивания гладкой поверхности, например полимерной пленки, меньше 90 o , то шероховатость (ткань из волокон этого полимера) уменьшает его, если же он больше 90 o , то шероховатость его увеличивает. Для составной поверхности, которая специфична для большинства текстильных материалов, наличие участков различной природы может быть учтено введением коэффициентов x, характеризующих долю поверхности с различными свойствами. Например, если текстильный материал изготовлен из волокон двух видов 1 и 2, то
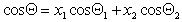
Если переплетение нитей таково, что получается сетчатый или дырчатый материал, то уравнение (2.50) принимает вид
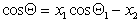
где х2 – доля открытой поверхности.
Как мы обсуждали выше, поверхностное натяжение можно разделить на компоненты дисперсионных и полярных сил, а при нахождении межфазового натяжения для многих жидких границ можно ограничиться лишь дисперсионной составляющей. Такое ограничение позволяет провести обсуждение явления смачивания (по крайней мере, низкоэнергетических поверхностей, к каковым можно отнести подавляющее большинство волокнообразующих полимеров), в рамках теории дисперсионных сил.
Как показал Н. В. Чураев смачивание неполярной жидкостью твердой поверхности возможно, если будет соблюдаться условие смачивания, которое выражается уравнением
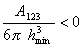
где А123 – составная постоянная Гамакера при взаимодействии жидкости (фаза 2) с твердым телом (фаза 1) на границе с воздухом (фаза 3); hmin — наименьшая толщина пленки, которая фактически соответствует Ван-дер-Ваальсову расстоянию, т.е. hmin = (0,22¸0,24) нм. Например, для воды на поверхности тефлона А123 = -7·10 — 21 Дж.
Учет только дисперсионных сил приводит к уравнению
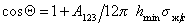
При расчетах углов смачивания твердых поверхностей следует учитывать поверхностное давление пленки, образованной при адсорбции из газо-паровой фазы. Тогда с учетом уравнения (1.2.48), уравнение Юнга (1.2.45) следует записать в виде
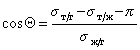
Способ расчета поверхностного давления предложили Бэнгхэм и Разорук:
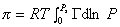
где P – равновесное давление, Г– равновесная адсорбция газа (пара), Ps – давление насыщения.
При больших углах смачивания и слабом взаимодействии жидкости с твердым телом поверхностное давление обычно не учитывают.
Для неполярных жидкостей на низкоэнергетической поверхности твердого тела для работы адгезии было получено выражение
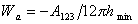
Поэтому уравнение Дюпре (1.2.46) можно записать
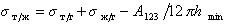
Для дисперсионной составляющей жидкости
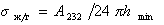
где А232 – постоянная Гамакера взаимодействия жидкости через прослойку газа (пара).
Сочетая уравнения (1.2.47), (1.2.55) и (1.2.56), получаем
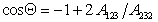
Очевидно, что Q = 0, т.е. при полном смачивании, cosQ = 1, если
Уравнение (1.2.57) позволяет прогнозировать вероятность смачивания (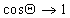
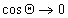
Чаще, однако, прибегают к определению постоянной Гамакера по известному значению межфазового натяжения на границе «твердое тело — газ». Эту характеристику поверхности твердого тела находят при распространении подхода Джирифалько и Гуда, рассмотренного нами выше для границы двух жидкостей, на поверхность раздела «жидкость — твердое тело», уравнения (1.2.23), (1.2.35).
Так приложение уравнения (1.2.34) к уравнению Юнга для случая смачивания неполярной жидкостью поверхности полимерного материала позволяет получить уравнение, известное как уравнение Фоукса, при
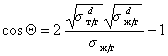
Если жидкости неполярны и 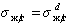
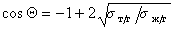
Уравнение (1.2.59) Зисман предложил использовать для определения поверхностного натяжения твердых тел. Очевидно, что при 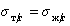
Естественно, что метод Зисмана ограничен некоторыми условиями, в частности, из уравнения (1.2.57) следует, что полное смачивание возможно при дисперсионной неразличимости твердого тела и жидкости, т.е. при А232= А123.
В действительности такого условия никогда невозможно достигнуть хотя бы потому, что если жидкость и твердое тело будут иметь одинаковый химический состав, их постоянные Гамакера будут различаться из-за различий в плотности.
Другое ограничение, связанное с применением метода Зисмана, основано на том, что использовать для измерения краевых углов смачивания следует лишь неполярные жидкости. Наиболее целесообразно применять гомологические ряды жидкостей. При величине поверхностного натяжения жидкостей более 35 мДж/м 2 метод Зисмана уже дает высокую погрешность, так как необходимо учитывать вклад полярных сил, которые в отличие от дисперсионной составляющей могут иметь и отрицательное значение. С другой стороны, приложение для смачивания твердых тел полярными жидкостями уравнения Ву (1.2.36) позволяет рассчитать полярную составляющую поверхностного натяжения жидкости, если для одной из неполярных жидкостей измерить краевой угол смачивания. Для расчета используют уравнение
Рис. 1.25. Зависимость смачивания поверхностей от поверхностного натяжения жидкостей. Материал поверхности: 1- FC-721; 2- ПТФЭ (тефлон); 3 — полиэтилен
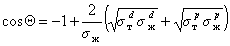
Этот метод позволил разделить величину поверхностного натяжения жидкостей на полярную и дисперсионную компоненты и определить поверхностное натяжение многих волокнообразующих полимеров.
Пример зависимости косинуса угла смачивания поверхности пленок различными жидкостями приведен на рис.1.25. Для описания этих зависимостей Зисман предложил использовать эмпирическое уравнение
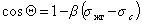
где bэмпирическая постоянная, sс – «критическое» поверхностное натяжение твердого тела, при котором происходит полное смачивание твердого тела жидкостью. Очевидно, что cos Q =1 при условии sжг = sс .
Как мы обсуждали выше, этот критерий в известной мере является условным, хотя и отражает энергетическое состояние поверхности твердого тела.
Реальное значение поверхностного натяжения твердого тела экспериментально определить невозможно, также как и рассчитать его теоретически. В этой связи метод Зисмана нашел широкое применение в практике исследования полимерных материалов, а также полимерных покрытий тканей, используемых в качестве отделочных материалов
http://pandia.ru/text/78/062/79852.php
http://xumuk.ru/colloidchem/35.html