Азот: решение уравнений ОВР методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры уравнений окислительно-восстановительных реакций азота (См. Азот и его соединения).
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций азота
1. Уравнение термической реакции окисления азота:
2. Уравнение реакции азота с водородом:
3. Уравнение реакции азота с магнием:
4. Уравнение реакции азота с углеродом в нейтральной среде:
5. Уравнение реакции азота карбидом кальция с образованием цианамида кальция:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Нитрат калия: способы получения и химические свойства
Нитрат калия KNO3 — соль щелочного металла калия и азотной кислоты. Белый. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 101,10; относительная плотность для тв. и ж. состояния d = 2,109; tпл = 334, 5º C;
Способ получения
1. Нитрат калия можно получить при 70º С путем взаимодействия надпероксида калия и оксида азота (IV), образуется нитрат калия и кислород:
2. В результате взаимодействия разбавленной азотной кислоты и гидроксида калия образуется нитрат калия и вода:
3. В результате реакции между горячим гидроксидом калия, оксидом азота (IV) и кислородом, происходит образование нитрата калия и воды:
4. В результате взаимодействия горячего и разбавленного раствора нитрита калия и кислорода образуется нитрат калия:
5. При смешивании горячего пероксида водорода и нитрита калия в разбавленной серной кислоте происходит образование нитрата калия и воды:
Качественная реакция
Качественная реакция на нитрат калия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат калия образует сульфат калия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат калия разлагается при температуре 400–520º С с образованием нитрита калия и кислорода:
2. Н итрат калия может реагировать с простыми веществами :
2.1. Н итрат калия реагирует со свинцом при температуре 350–400 ºС . При этом образуется нитрит калия и оксид свинца:
KNO3 + Pb = KNO2 + PbO
2.2. Нитрат калия реагирует при температуре 400º С с алюминием с образованием алюмината калия, оксида алюминия и азота:
2.3. Нитрат калия взаимодействует с атомным водородом в присутствии цинка и разбавленной соляной кислоты при этом образуются нитрит калия и вода:
при взаимодействии нитрата калия и водорода при кипении в присутствии алюминия и концентрированного гидроксида калия образуется газ аммиак, вода и гидроксид калия:
3KNO3 + 8Al + 5KOH+ 18H2O = 3NH3↑ + 8K[Al(OH)4]
3. Возможны реакции между нитратом калия и сложными веществами :
3.1. Нитрат калия вступает в реакцию с кислотами :
3.1.1. В результате реакции в вакууме между нитратом калия и концентрированной серной кислотой образуется гидросульфат калия и азотная кислота:
3.2. Нитрат калия взаимодействует с солями :
3.2.1. Нитрат калия реагирует с сульфатом аммония при нагревании. В результате данной реакции образуются сульфат калия, оксид азота (I) и вода:
Химия, Биология, подготовка к ГИА и ЕГЭ
Окислительные свойства азотной кислоты.
ОВР в статье специально выделены цветом . Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
автор статьи — Саид Лутфуллин
Азотная кислота – в любом виде (и разбавленная, и концентрированная) является сильным окислителем.
Причем, разбавленная восстанавливается глубже, чем концентрированная.
Окислительные свойства обеспечиваются азотом в высшей степени окисления +5
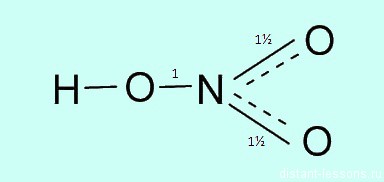
Какая валентность у азота в этом соединении? Вопрос очень хитрый, многие отвечают на него корректно. У азота в азотной кислоте валентность IV .
Атом азота не может образовать больше ковалентных связей, посмотрите на электронную диаграмму:
Три связи с каждым атомом кислорода, и четвертая как бы распределяется, образуется полуторная связь. Таким образом, валентность азота IV, а степень окисления +5
Первое самое интересное свойство: взаимодействие с металлами.
Водород при взаимодействии с металлами никогда не выделяется
Схема реакции азотной кислоты (и разбавленной, и концентрированной) с металлами:
HNO 3 + Ме → нитрат + H 2 O + продукт восстановленного азота
1. Алюминий, железо и хром с концентрированной азотной кислотой в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2. С платиной и золотом концентрированная азотная кислота не реагирует вообще.
Чтобы понять до чего вообще может восстанавливаться азот, посмотрим на диаграмму его степеней окисления:
Азот +5 – окислитель, будет восстанавливаться, то есть понижать степень окисления.
Все возможные продукты восстановления азотной на диаграмме обведены красным.
(Не все конечно, такие реакции вообще что угодно дать могут, но в ЕГЭ образуются только эти).
Определить какой именно продукт будет образовываться можно чисто логически:
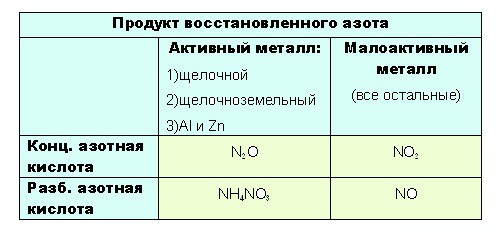
- до таких низких степеней окисления как -3 или +1, с образованием продуктов NH 4 NO 3 или N 2 O соответственно, азот восстанавливают только достаточно сильные, активные металлы: щелочные — 1-я группа главная подгруппа, щелочноземельные, а так же Al и Zn . Как ранее уже было сказано, разбавленная кислота восстанавливается глубже, поэтому при взаимодействии активных металлов с конц. азотной кислотой образуется N 2 O , а при взаимодействии с разб. азотной кислотой NH 4 NO 3.
Остальные металлы восстанавливают азотную кислоту до +2 или +4, с образованием продуктов соответственно: NO или O 2.
Разбавленная кислота восстанавливается глубже
- при взаимодействии с ней металлов, не отличающихся особой активностью, будет образовываться NO . Ну а с конц. азотной NO 2:
(обратите внимание, что железо окисляется до высшей степени окисления)
Если тяжело сразу понять всю логичность выбора, вот таблица:
А зотная кислота окисляет неметаллы до высших оксидов.
Так как неметаллы – не такие сильные восстановители, как активные металлы, азот может восстановиться только до +4, образовав NO 2 или NO соответственно.
При окислении неметаллов концентрированной азотной кислотой образуется бурый газ ( NO 2), а если кислота разбавленная, то образуется NO . Схемы реакций следующие:
неметалл + HNO 3(разб.) → соединение неметалла в высшей степени окисления + NO
неметалл + HNO 3(конц.) → соединение неметалла в высшей степени окисления + NO 2
(угольная кислота не образуется, так как она не стабильна)
- концентрированная азотная кислота окисляет сероводород. Окисление идет глубже при нагревании:
- концентрированная азотная кислота окисляет сульфиды до сульфатов:
- азотная кислота настолько сурова, что может окислить даже ГАЛОГЕН. Только один – иод. Разбавленная восстанавливается глубже: до +2, концентрированная до +4. А вот иод окисляется не до высшей степени окисления +7 (слишком круто), а до +5, образуя иодноватую кислоту HIO 3:
- концентрированная азотная кислота реагирует с хлоридами и фторидами. Только следует понимать, что с фторидами и хлоридами протекает обычная реакция ионного обмена с вытеснением галогеноводорода и образованием нитрата:
- А вот с бромидами и иодидами (и с бромоводородами, и с иодоводородами) протекает ОВР. В обоих случаях образуется свободный галоген, а азот восстанавливается до NO 2:
Образовавшийся иод окисляется дальше до иодноватой кислоты, поэтому реакцию можно записать сразу:
То же самое происходит при взаимодействии с иодо- и бромоводородами:
Реакции с золотом, магнием, медью и серебром
http://chemege.ru/nitrat-kaliya/
http://distant-lessons.ru/okislitelnye-svojstva-azotnoj-kisloty.html