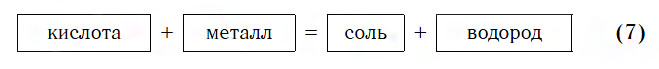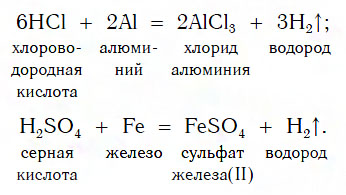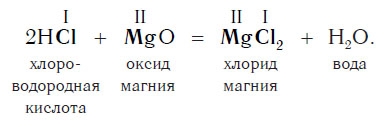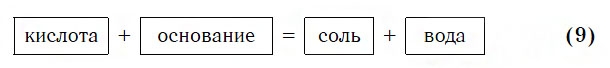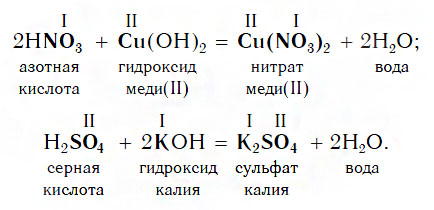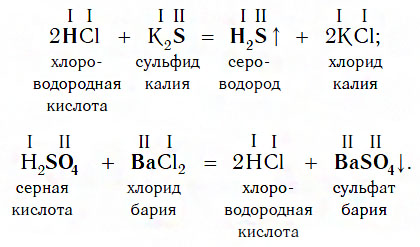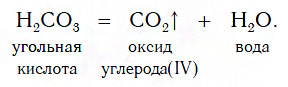Урок №48. Химические свойства кислот
Химические свойства кислот
Универсальная индикаторная бумага
» jsaction=»rcuQ6b:WYd;»>
2.Реагируют с металлами в ряду активности до H 2 (искл. HNO 3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H 2 ↑ (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O ( р. обмена)
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO 4 > HBr > HCl > H 2 SO 4 > HNO 3 > HMnO 4 > H 2 SO 3 > H 3 PO 4 > HF > HNO 2 >H 2 CO 3 > H 2 S > H 2 SiO 3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании ( искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
Сероводородная кислота в продуктах выделяется в виде газа:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций:
Назовите продукты реакции.
№2. Составьте уравнения реакций, назовите продукты:
№3. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
Урок 35. Химические свойства кислот
В уроке 35 «Химические свойства кислот» из курса «Химия для чайников» узнаем о всех химических свойствах кислот, рассмотрим с чем они реагируют и что при этом образуется.
В состав молекулы любой кислоты обязательно входят атомы водорода, связанные с различными кислотными остатками. Такое подобие состава молекул обусловливает подобие химических свойств кислот. Оно выражается в том, что кислоты в водных растворах проявляют схожие химические свойства, называемые кислотными свойствами. Знание этих свойств очень важно для дальнейшего изучения химии, поэтому познакомимся с ними более подробно и систематизируем изученный ранее материал.
Изменение окраски индикаторов
Вы уже знаете, что для доказательства наличия кислоты или щелочи в растворе можно использовать особые вещества — индикаторы.
Вспомните, в какие цвета окрашены растворы индикаторов лакмуса, метилоранжа и фенолфталеина. Как изменяется их окраска в растворах кислот?
Взаимодействие с металлами
Из материала предыдущих тем вам известно, что в водных растворах многие кислоты реагируют с металлами, расположенными в ряду активности левее Н2 (например, Mg, Al, Zn, Fe). В результате этих реакций образуются сложные вещества — соли и выделяется газообразное простое вещество — водород:
В такие реакции вступают как бескислородные (HCl, HBr), так и кислородсодержащие (H2SO4, H3PO4) кислоты, например:
Реакции этого типа, как вы уже знаете, относятся к реакциям замещения: атомы металлов замещают (вытесняют) атомы водорода из молекул кислот.
Следует помнить, что металлы, расположенные в ряду активности правее Н2 (Сu, Ag, Hg и др.), с указанными кислотами в
водных растворах не реагируют.
Реакции с основными оксидами
Еще в младших классах, изучая математику, вы узнали, что от перемены мест слагаемых сумма не изменяется: 2 + 3 = 5; 3 + 2 = 5.
Похожее правило есть и в химии: если в уравнении реакции исходные вещества поменять местами, то ее продукты от этого не изменятся. Так, например, изучив ранее химические свойства основных оксидов, вы узнали, что они реагируют с кислотами с образованием солей и воды. Зная это, вы можете теперь смело утверждать, что кислоты реагируют с основными оксидами, образуя те же продукты — соли и воду:
Пример уравнения реакции, протекающей в соответствии с этой схемой:
Как вам уже известно, эти реакции относятся к реакциям обмена, поскольку в процессе взаимодействия исходные сложные вещества обмениваются своими составными частями.
Взаимодействие с основаниями
Изучая химические свойства оснований, вы узнали, что они реагируют с кислотами с образованием солей и воды. А что же тогда образуется при взаимодействии кислот с основаниями? Правильно, те же самые продукты — соли и вода! Мы еще раз убедились в том, что состав конечных веществ не зависит от того, в каком порядке смешиваются одни и те же исходные вещества. Итак, составим схему, согласно которой кислоты реагируют с основаниями:
Запомните, что в образующейся соли валентность атомов металла такая же, как в исходном основании, а валентность кислотного остатка такая же, как в исходной кислоте.
Кислоты реагируют как с нерастворимыми, так и с растворимыми основаниями, например:
Реакции этого типа, как и предыдущего, относятся к реакциям обмена. Вспомните, как называется реакция, которую отображает последнее уравнение. Почему она так называется?
Взаимодействие с солями
Еще один класс сложных веществ, с которыми кислоты могут вступать в химическое взаимодействие, — соли. Реакции этого типа идут по общей схеме:
Однако сразу заметим, что кислота реагирует в растворе с солью лишь в том случае, если в результате реакции выделяется газ (↑) или образуется нерастворимое вещество, выпадающее в осадок (↓). Примеры таких реакций:
Очевидно, что реакции этого типа, как и двух предыдущих, относятся к реакциям обмена.
Разложение кислот на кислотные оксиды и воду
Известно несколько кислот, которые достаточно легко разлагаются на соответствующий кислотный оксид и воду. К таким кислотам, которые называют неустойчивыми, относят угольную (H2CO3), сернистую (H2SO3) и кремниевую (H2SiO3) кислоты. Особенно неустойчива угольная кислота — она разлагается на кислотный оксид CO2 и воду уже при комнатной температуре:
Краткие выводы урока:
- Кислоты в растворах изменяют окраску индикаторов.
- Кислоты реагируют с металлами, основными оксидами, основаниями и солями.
Надеюсь урок 35 «Химические свойства кислот» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
ИСПЫТАНИЕ РАСТВОРОВ КИСЛОТ ИНДИКАТОРАМИ.
ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ, ОКСИДАМИ МЕТАЛЛОВ, ОСНОВАНИЯМИ И СОЛЯМИ.
Теоретическая часть
Кислотами называются сложные вещества, в состав молекул которых входят атомы водорода, способные замещаться или обмениваться на атомы металла и кислотный остаток.
Рассмотрим важнейшие химические свойства кислот.
1. Действие растворов кислот на индикаторы. Практически все кислоты (кроме кремниевой) хорошо растворимы в воде. Растворы кислот в воде изменяют окраску специальных веществ – индикаторов. По окраске индикаторов определяют присутствие кислоты. Индикатор лакмус окрашивается растворами кислот в красный цвет, индикатор метиловый оранжевый – тоже в красный цвет.
2. Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
| кислота | основание | соль | вода | |||
| H2SO4 | + | Ca(OH)2 | = | CaSO4 | + | 2 H2O |
| H3PO4 | + | Fe(OH)3 | = | FePO4 | + | 3 H2O |
Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. Поскольку практически все кислоты растворимы в воде, они вступают в реакции нейтрализации не только с растворимыми, но и с нерастворимыми основаниями. Исключением является кремниевая кислота, которая плохо растворима в воде и поэтому может реагировать только с растворимыми основаниями – такими как NaOH и KOH:
3. Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
| кислота | оксид | соль | вода | |||
| 2 HCl | + | CaO | = | CaCl2 | + | H2O |
| H3PO4 | + | Fe2O3 | = | 2 FePO4 | + | 3 H2O |
Как и в случае реакций с основаниями, с основными оксидами кислоты образуют соль и воду. Соль содержит кислотный остаток той кислоты, которая использовалась в реакции нейтрализации.
4. Взаимодействие кислот с металлами. Это взаимодействие происходит при соблюдении ряда условий:
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
| кислота | металл | соль | ||||
| HCl | + | Hg | = | не образуется | ||
| 2 HCl | 2 Na | = | 2 NaCl | + | H2 | |
| H2SO4 | + | Zn | = | ZnSO4 | + | H2 |
По реакционной способности в отношении кислот все металлы располагаются в ряд активности металлов (табл.1). Слева находятся наиболее активные металлы, справа – неактивные. Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами.
Табл.1. Ряд активности металлов.
| Металлы, которые вытесняют водород из кислот | Металлы, которые не вытесняют водород из кислот |
| K Ba Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) самые активные металлы | Cu Hg Ag Pt Au самые неактивные металлы ® |
Во-вторых, кислота должна быть достаточно сильной, чтобы реагировать даже с металлом из левой части таблицы 1. Под силой кислоты понимают ее способность отдавать ионы водорода H + .
Например, кислоты растений (яблочная, лимонная, щавелевая и т.д.) являются слабыми кислотами и очень медленно реагируют с такими металлами как цинк, хром, железо, никель, олово, свинец (хотя с основаниями и оксидами металлов они способны реагировать).
С другой стороны, такие сильные кислоты как серная или соляная (хлороводородная) способны реагировать со всеми металлами из левой части таблицы.
В связи с этим существует еще одна классификация кислот – по силе. В таблице 2 в каждой из колонок сила кислот уменьшается сверху вниз.
Таблица 2. Классификация кислот на сильные и слабые кислоты.
| Сильные кислоты | Слабые кислоты |
| HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная | HF фтороводородная H3PO4 фосфорная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
Следует помнить, что в реакциях кислот с металлами есть одно важное исключение. При взаимодействии металлов с азотной кислотой водород не выделяется. Это связано с тем, что азотная кислота содержит в своей молекуле сильный окислитель – азот в степени окисления +5. Поэтому с металлами в первую очередь реагирует более активный окислитель N +5 , а не H + , как в других кислотах. Выделяющийся все же в каком-то количестве водород немедленно окисляется и не выделяется в виде газа. Это же наблюдается и для реакций концентрированной серной кислоты, в молекуле которой сера S +6 также выступает в роли главного окислителя. Состав продуктов в этих окислительно-восстановительных реакциях зависит от многих факторов: активности металла, концентрации кислоты, температуры. Например:
Есть металлы, которые реагируют с разбавленными кислотами, но не реагирует с концентрированными (т.е. безводными) кислотами – серной кислотой и азотной кислотой.
Эти металлы – Al, Fe, Cr, Ni и некоторые другие – при контакте с безводными кислотами сразу же покрываются продуктами окисления (пассивируются). Продукты окисления, образующие прочные пленки, могут растворяться в водных растворах кислот, но нерастворимы в кислотах концентрированных.
Это обстоятельство используют в промышленности. Например, концентрированную серную кислоту хранят и перевозят в железных бочках.
5.Взаимодействие кислот с солями. Кислоты взаимодействуют с солями, если в результате реакции образуется осадок или газ. Например:
Экспериментальная часть
ЦЕЛЬ РАБОТЫ: экспериментально осуществить реакции, характеризующие химические свойства кислот.
ОБОРУДОВАНИЕ И РЕАКТИВЫ: штатив с пробирками, спиртовка, пробиркодержатель, стеклянная лопаточка, фенолфталеин, метиловый оранжевый, универсальная индикаторная бумага, раствор соляной кислоты, стружки магния, алюминий, цинк, медь, оксид меди (II), гидроксид калия, нитрат серебра, карбонат натрия.
ОПЫТ 1. ИСПЫТАНИЕ РАСТВОРОВ КИСЛОТ ИНДИКАТОРАМИ.
К 6-7 каплям раствора кислоты прилейте 2-3 капли индикатора метилового оранжевого. Как изменился цвет? Испытайте раствор кислоты другими индикаторами. Заполните таблицу, которая предлагается ниже.
| Кислота | Цвет индикатора | |
| метиловый оранжевый | фенолфталеин | универсальная индикаторная бумага |
ОПЫТ 2. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С МЕТАЛЛАМИ.
В пробирки положите разные металлы: в 1-ую пробирку — Mg, во 2 –ую — Al, в 3-ю — Zn, в 4-ую — Cu. Во все пробирки налейте по 1 мл раствора соляной кислоты. Что наблюдаете? Сделайте общий вывод об отношении кислот к металлам. Составьте уравнения протекающих реакций.
ОПЫТ 3. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОКСИДАМИ МЕТАЛЛОВ.
На дно сухой пробирки поместите с помощью стеклянной лопаточки немного порошка CuO и прилейте 5 капель соляной кислоты. Содержимое пробирки взболтайте. Какого цвета образуется раствор? Если реакция не наблюдается, слегка нагрейте пробирку. Составьте уравнение проделанной реакции.
ОПЫТ 4. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С ОСНОВАНИЯМИ.
В пробирку внесите 5 капель гидроксида калия и каплю фенолфталеина. Какого цвета получился раствор? Прибавьте несколько капель соляной кислоты до обесцвечивания. Содержимое пробирки осторожно взболтайте. Объясните, почему исчезает окраска раствора. После исчезновения малиновой окраски потрогайте пробирку, где находится раствор, рукой. Какой можно сделать вывод: реакция нейтрализации происходит с поглощением или с выделением тепла. Составьте уравнение проделанной реакции.
ОПЫТ 5. ВЗАИМОДЕЙСТВИЕ КИСЛОТ С СОЛЯМИ.
В одну пробирку налейте 3-4 мл раствора нитрата серебра, в другую – карбоната натрия. В каждую из них добавьте столько же соляной кислоты. Встряхните содержимое пробирок. Что наблюдаете? Составьте молекулярные и ионные уравнения реакций.
Задания.
1. Дайте определение кислотам исходя из их состава.
2. Дайте определения кислотам с точки зрения теории электролитической
3. Даны растворы двух веществ. Как можно практически доказать, что одно из них является раствором кислоты.
4. Какой из металлов, взятый для опытов, не реагирует с раствором соляной кислоты? Какие еще металлы не реагируют с этой кислотой?
5. К какому типу реакций относится взаимодействие кислоты с металлами?
6. Произойдет ли реакция нейтрализации, если прилить не кислоту к щелочи, а, наоборот, щелочь к кислоте?
7. К какому типу реакции нужно отнести реакцию нейтрализации?
http://himi4ka.ru/arhiv-urokov/urok-35-himicheskie-svojstva-kislot.html
http://megalektsii.ru/s50832t7.html