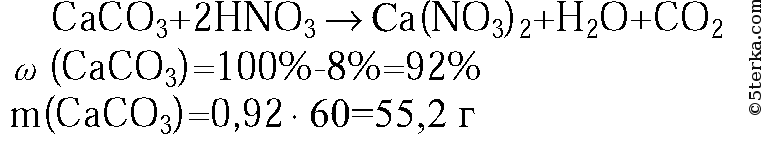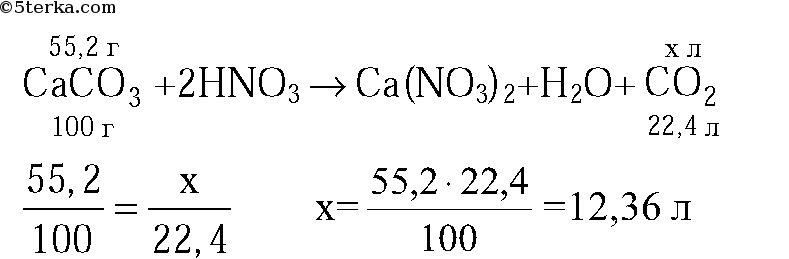Напишите уравнения реакций: а) оксида углерода(iv) с известковой водой; б) углерода с водородом; в) горения углерода в избытке кислорода
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Вариант 2
Вопросы:
1. В виде каких простых веществ углерод встречается в природе? Сравните их физические свойства. Объясните зависимость физических свойств от структуры кристаллической решетки.
2. Напишите уравнения реакций: а) оксида углерода(IV) с известковой водой; б) углерода с водородом; в) горения углерода в избытке кислорода.
3. Какой объем воздуха (н. у.) расходуется при полном сгорании 84 л оксида углерода(II)? Объемная доля кислорода в воздухе составляет 21 %. (Ответ: 200 л.)
Ответы и решения:
1. Углерод в природе встречается в виде:
а) алмаза — очень твердое, прочное вещество с высокой tпл, кристаллическая решетка — атомная.
б) графита — твердое вещество, жирное на ощупь с высокой tпл электро- и теплопроводен, кристаллическая решетка атомная.
в) карбина — твердое вещество (тверже графита, но мягче алмаза), черный мелкокристаллический порошок, обладает полупроводниковыми свойствами. Кристаллическая решетка атомная.

задача №2
к главе «Тема IV. Подгруппа углерода. Работа 1. Углерод. Оксиды углерода».
9 класс. Химия. Неорганические соединения углерода
9 класс. Химия. Неорганические соединения углерода
- Оглавление
- Занятия
- Обсуждение
- О курсе
Вопросы
Задай свой вопрос по этому материалу!
Поделись с друзьями
Комментарии преподавателя
Оксид углерода (II), или, как его еще можно назвать, монооксид углерода, а также угарный газ – это несолеобразующий оксид. По своим физическим свойствам оксид углерода (II) – бесцветный газ, без запаха, плохо растворимый в воде. Угарным газом это вещество называют потому, что оно очень ядовито.
Монооксид углерода образуется при неполном сгорании угля или органических веществ:
В лаборатории его легче всего получить, действуя на муравьиную кислоту концентрированной серной кислотой, которая связывает воду:
Оксид углерода (II) – сильный восстановитель, его широко используют в металлургии для восстановления металлов из их оксидов:
СО + CuO = Cu + CO2
В кислороде и на воздухе оксид углерода (II) горит голубоватым пламенем, выделяя много теплоты, при этом образуется оксид углерода (IV):
2СО + О2 = 2СО2 + 577 кДж
Оксид углерода (IV), или диоксид углерода, а также углекислый газ является типично кислотным оксидом, в котором углерод находится в степени окисления +4. Этот оксид способен взаимодействовать с водой с образованием угольной кислоты, с основными оксидами и щелочами.
Углекислый газ не имеет цвета и запаха, в 1,5 раза тяжелее воздуха и неплохо растворим в воде. Всем известная газированная вода – это раствор оксида углерода (IV) в воде. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
При растворении оксида углерода (IV) в воде образуется угольная кислота:
СО2 + Н2О ↔ Н2СО3
Эта кислота относится к слабым кислотам и в водном растворе подвергается ступенчатой диссоциации:
Для угольной кислоты характерно образование кислых солей.
ОПЫТ 1. Пропустим через раствор гидроксида кальция углекислый газ, получаем нерастворимый карбонат кальция (Рис. 2).
Ca(OH)2 + CO2 = CaCO3 ↓ + H2O
Рис. 2. Карбонат кальция
Карбонаты – соли угольной кислоты, в которых замещены оба иона водорода. Когда замещен только один ион водорода, получаются гидрокарбонаты. Большинство карбонатов – нерастворимые соединения, все гидрокарбонаты – растворимые. Нерастворимый карбонат превращается в растворимый гидрокарбонат при пропускании через раствор с осадком углекислого газа.
CaCO3 + CO2 + H2O ↔ Ca(HCO3)2
При нагревании раствора гидрокарбоната выделяется углекислый газ, и вновь образуется нерастворимый карбонат кальция.
Ca(HCO3)2 = CaCO3↓ + CO2 + H2O
Разложение гидрокарбонатов при небольшом нагревании нашло свое применение. Например, гидрокарбонат натрия (в быту он называется пищевой содой) начинает разлагаться уже при 50°С:
2NaHCO3 = Na2CO3 + H2O + CO2↑
Пищевую соду используют, например, при выпечке хлеба. При нагревании она разлагается с образованием диоксида углерода, благодаря чему хлеб становится пышным.
Для всех солей угольной кислоты характерна обменная реакция с кислотами, признаком которой является выделение углекислого газа, так как в результате этой реакции образуется угольная кислота, которая сразу разлагается на воду и углекислый газ. Например, при взаимодействии карбоната кальция с соляной кислотой образуются хлорид кальция, вода и углекислый газ:
http://5terka.com/node/11449
http://www.kursoteka.ru/course/1944/lesson/6055/unit/16242