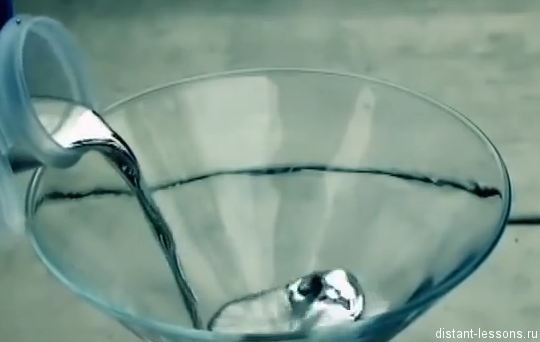Химия, Биология, подготовка к ГИА и ЕГЭ
Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
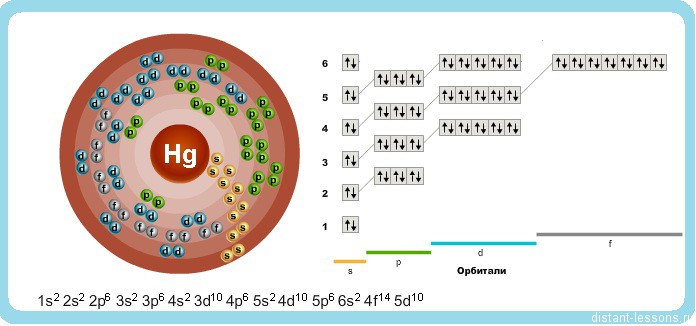
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
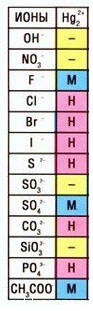
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Химические свойства ртути
Ртуть, в отличие от цинка, малоактивный металл, в сухом воздухе устойчива, подобно благородным металлам.
1. Взаимодействие с неметаллами
Выше 300°С окисляется кислородом, образуя оксид ртути (II):
Очень легко взаимодействует с серой с образованием сульфида ртути (II):
При нормальных условиях реагирует с галогенами:
При нагревании – с фосфором, образуя фосфид:
С водородом, азотом, бором, кремнием, углеродом ртуть не взаимодействует.
2. Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов ртуть находится после водорода; с водой, щелочами и неокисляющими кислотами не взаимодействует.
Растворяется в разбавленной и концентрированной азотной кислоте и концентрированной серной кислоте, образуя соли ртути и продукты восстановления кислот:
при избытке ртути возможно образование сульфата ртути (I):
3. Взаимодействие с солями
Ртуть взаимодействует с солями ртути (II) с образованием солей ртути (I):
Другие металлы, из-за малой активности, вытеснять из растворов не может.
Получение Ртути.
Ртутные руды (или рудные концентраты), содержащие Ртуть в виде киновари, подвергают окислительному обжигу
Обжиговые газы, пройдя пылеуловительную камеру, поступают в трубчатый холодильник из нержавеющей стали или монель-металла. Жидкая Ртуть стекает в железные приемники. Для очистки сырую Ртуть пропускают тонкой струйкой через высокий (1-1,5 м) сосуд с 10%-ной НNО3, промывают водой, высушивают и перегоняют в вакууме.
Возможно также гидрометаллургическое извлечение Ртути из руд и концентратов растворением HgS в сернистом натрии с последующим вытеснением Ртути алюминием. Разработаны способы извлечения Ртуть электролизом сульфидных растворов.
Ртуть широко применяется при изготовлении научных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы, полярографы, капиллярные электрометры и других), в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом, в качестве катализатора при синтезе уксусной кислоты, в металлургии для амальгамации золота и серебра, при изготовлении взрывчатых веществ; в медицине (каломель, сулема, ртутьорганические и других соединения), в качестве пигмента (киноварь), в сельском хозяйстве (органические соединения Ртути) в качестве протравителя семян и гербицида, а также как компонент краски морских судов (для борьбы с обрастанием их организмами). Ртуть и ее соединения токсичны, поэтому работа с ними требует принятия необходимых мер предосторожности.
Ртуть в организме.
Содержание Ртути в организмах составляет около 10 -6 %. В среднем в организм человека с пищей ежесуточно поступает 0,02-0,05 мг Ртути. Концентрация Ртути в крови человека составляет в среднем 0,023 мкг/мл, в моче — 0,1-0,2 мкг/мл. В связи с загрязнением воды промышленного отходами в теле многих ракообразных и рыб концентрация Ртути (главным образом в виде ее органических соединений) может значительно превышать допустимый санитарно-гигиенический уровень. Ионы Ртути и ее соединения, связываясь с сульфгидрильными группами ферментов, могут инактивировать их. Попадая в организм, Ртуть влияет на поглощение и обмен микроэлементов — Cu, Zn, Cd, Se. В целом биологическая роль Ртуть в организме изучена недостаточно. Отравления Ртутью и ее соединениями возможны на ртутных рудниках и заводах, при производстве некоторых измерительных приборов, ламп, фармацевтических препаратов, инсектофунгицидов и других.
Основную опасность представляют пары металлической Ртути, выделение которых с открытых поверхностей возрастает при повышении температуры воздуха. При вдыхании Ртуть попадает в кровь. В организме Ртуть циркулирует в крови, соединяясь с белками; частично откладывается в печени, в почках, селезенке, ткани мозга и др. Токсическое действие связано с блокированием сульфгидрильных групп тканевых белков, нарушением деятельности головного мозга (в первую очередь, гипоталамуса). Из организма Ртуть выводится через почки, кишечник, потовые железы и др.
Острые отравления Ртутью и ее парами встречаются редко. При хронических отравлениях наблюдаются эмоциональная неустойчивость, раздражительность, снижение работоспособности, нарушение сна, дрожание пальцев рук, снижение обоняния, головные боли. Характерный признак отравления — появление по краю десен каймы сине-черного цвета; поражение десен (разрыхленность, кровоточивость) может привести к гингивиту и стоматиту. При отравлениях органических соединениями Ртути (диэтилмеркурфосфатом, диэтилртутью, этилмеркурхлоридом) преобладают признаки одновременного поражения центральной нервной (энцефалополиневрит) и сердечно-сосудистой систем, желудка, печени, почек.
Качественная реакция наHg 2+ : при добавлении к раствору соли ртути(II) щелочи выпадает оранжевый осадок ОКСИДА ртути, гидроксид не образуется, его не существует:
Ион Zn 2+ с S 2+ образует белый осадок. Который растворяется в кислотах с выделением газа с запахом тухлых яиц – сероводорода (про него подробнее ниже, в разделе сера):
Сокращенное ионное уравнение:
ZnS + H2SO4 → ZnSO4 + H2S↑ (растворение осадка с выделением сероводорода)
Be 0 (Be 2+ ), Zn 0 (Zn 2+ ),Al 0 (Al 3+ )
эти три металла объединяют амфотерные свойства. Поэтому если в задании встречается следующая формулировка: «…металл, растворимый в растворе щелочи…», «…металл, который растворяется и в щелочах, и кислотах…» или «…металл, растворяющийся в щелочи с выделением горючего газа, легче воздуха…», то имеют в виду один из этих трех металлов.
Ионы этих металлов в растворах тоже определяют добавлением щелочи.
Выпадает белый студенистый осадок (гидроксид металла),который в избытке щелочи растворяется (гидроксиды алюминия, цинка и бериллия реагируют со щелочами, образуя растворимые гидроксоалюминаты, гидроксоцинкаты и гидроксобериллаты соответственно):
ZnCl2 + 2KOH → Zn(OH)2↓ + 2KCl (образование осадка)
Ртуть
Общие сведения и методы получения
Ртуть ( Hg ) — серебристо-белый тяжелый металл, жидкий при комнатной температуре. При замерзании ртуть становится белой, в твердом состоянии легко поддается обработке и имеет зернистый излом. Самородная ртуть была известна за 2000 лет до н. э. Народы древней Индии н Китая, а также греки и римляне применяли киноварь (природный HgS ) как краску, лекарственное и косметическое средство. Греческий врач Диоскорид (I в. до н.э.), нагревая киноварь в железном сосуде с крышкой, получил ртуть в виде паров, которые конденсировались на ее внутренней поверхности. Продукт реакции был назван hydrargyros
(от греческого hydor — «вода» и argyros — «серебро»), т.е. жидким серебром. Происхождение русского названия «ртуть» не установлено
Твердая ртуть впервые получена в 1759 г. в Петербурге М. П. Брауном и М. В. Ломоносовым, которым удалось заморозить ее в смеси снега с концентрированной азотной кислотой.
Ртуть — весьма редкий элемент. Ее среднее содержание в земной коре —4,5- 10 _б % (по массе). Примерно в таком же количестве она содержится в изверженных горных породах. Известно 35 рудных минералов, содержащих ртуть в таких концентрациях, при которых промышленное использование этих минералов технически возможно и экономически целесообразно. Основной рудный минерал — киноварь HgS
с содержанием ртути 86,2 %. Из других минералов следует отметить метацинабарит, самородную ртуть или лнвингстонит, кордероит, ртуть-содержащие сульфасоли и т. д.
Ртутные руды делятся на богатые (
1 % Hg ), рядовые (0,2—0,3 % Hg ) и бедные (0,06—0,12% Hg ). Основное промышленное значение имеют телетермальные месторождения ртутных руд, которые разрабатываются подземным способом. Встречается ртуть также в разрабатываемых открытым способом вулканогенных месторождениях.
Существуют два основных способа извлечения ртути — пиро- и гидрометаллургический. В первом случае руды или концентраты, содержащие ртуть в виде HgS , подвергают окислительному обжигу. Полученная в результате обжига жидкая ртуть стекает в специальные приемники. Для последующей очистки ее пропускают через высокий (1,0—1,5 м) сосуд с 10 %-ной HN 03, промывают водой, высушивают и перегоняют в вакууме. Второй способ получения ртути состоит в растворении HgS в сернистом натрии н последующем вытеснении ртути алюминием. Разработаны способы извлечения ртути путем электролиза сульфидных растворов.
Атомные характеристики. Атомный номер 80, атомная масса 200,59 а. е. м., атомный объем 14,26*10 -6 м 3 /моль, атомный радиус 0,157 нм, нонный радиус Hg 2+ 0,110 нм. Конфигурация внешних электронных оболочек 5d 10 6s 2 . Потенциалы ионизации J (эВ): 10,43; 18,76; 34,21. Электроотрицательность 1,44. Твердая ртуть имеет ромбоэдрическую решетку с периодами а=0,3463 и с=0,671 нм. Известно семь устойчивых изотопов ртути с массовыми числами: 196 (распространенность 0,2 %), 198 (10%), 199 (16,8%), 200 (23,1 %), 201 (13,2%), 202 (29,8 %) и 204 (6,9%).
В соединениях проявляет степень окисления +2 и +1.
Ртуть является относительно стойким в химическом отношении элементом. По отношению к кислороду занимает место вблизи золота н серебра. Из металлов подгруппы цннка ртуть наименее активна вследствие высокой энергии ионизации. Нормальные электродные потенциалы реакций диссоциации 2 Hg ->-( Hg 2 ) 2+ + 2 e , ( Hg 2 ) 2+ ^-2 Hg 2 ++2 e н Hg ->—»- Hg 2+ +2 e равны соответственно 0,80; 0,91 н 0,86 В. Электрохимический эквивалент ртутн со степенью окисления +1 2,0789 мг/Кл, а со степенью окисления +2 1,03947 мг/Кл. Ртутные соединения относительно нестойки нз-за постоянной тенденции ртутн к переходу в атомную форму.
В соляной и разбавленной серной кислотах, а также в щелочах ртуть не растворяется. Легко растворяется в азотной кислоте, а при нагревании в концентрированной серной. Растворима в царской водке. Со слабыми кислотами ртуть не дает солей нли образует неустойчивые соли типа Hg 2 CQ 3 , которая прн нагревании до 180 °С разлагается на ртуть, ее оксид н С02.
С галогенами ртуть образует почти недиссоцнирующие, в большинстве своем ядовитые соединения. Практическое значение имеют йодная ртуть Hgl 2 , хлористая ртуть (каломель) Hg 2 Cl 2 н хлорная ртуть (сулема) HgCl 2 . Йодную ртуть получают воздействием ноднстого калия на растворенные в воде солн ртути. В аналитической химии с помощью этой реакции выявляют присутствие ртутн. Йодная ртуть существует в двух модификациях — красной и желтой. Переход из красной модификации в желтую происходит при 127 °С; обратный переход протекает медленно н требует переохлаждения. Каломель представляет собой бесцветные тетраэдрнческне кристаллы, постепенно темнеющие вследствие распада под действием света на сулему и ртуть. Сулема имеет внд бесцветных кристаллов ромбической формы. Чаще всего сулему получают прямым восстановлением ртутн.
Ртуть растворяется в расплавленном белом фосфоре, однако химических соединений не образует и прн остывании выделяется из расплава в химически неизменном виде.
Сернистую ртуть можно получить простым растиранием ртути с серным цветом при комнатной температуре. Сульфид ртутн HgS можно легко получить, воздействуя на ртуть сероводородом прн повышенных температурах.
На воздухе ртуть прн комнатной температуре не окисляется. При продолжительном нагреве до температур, близких к температуре кипения, ртуть соединяется с кислородом воздуха, образуя красный оксид (И) ртути HgO , который прн дальнейшем нагревании снова распадается на ртуть н кислород. В этом соединении степень окисления ртути равна + 2 Известен и другой окснд ртутн — черного цвета. Степень окисления ртутн в нем равна +1, его формула Hg 2 0 Во всех соединениях ртути (I) ее атомы связаны между собой, образуя двухвалентные группы — Hg 2 — илн — Hg — Hg —. Подобная связь сохраняется и в растворах солей ртути (I).
Известно существование гидрида HgH 2 , получаемого в результате взаимодействия нодида ртутн и литий — алюминий гидрида. Однако гидрид ртути очень неустойчив и распадается уже при 148 К.
Гидроксиды ртутн неизвестны. В тех случаях, когда можно ожидать нх образования, они вследствие своей неустойчивости немедленно отщепляют воду, образуя безводные оксиды.
Помимо галогенидов, известны и другие соли ртути Среди них сернистая ртуть HgS ; известны соли ртутн (И) цианистой и роданистой кислот, а также «гремучая ртуть» — соль гремучей кислоты— Hg ( ONC )2. Почти все солн ртути (И) плохо растворимы в воде. Исключение составляет нитрат Hg ( N 03)2. При воздействии на солн ртути аммиака образуются многочисленные комплексные соединения, например белый плавкий преципитат HgCl -2 NH 3 , белый неплавкий преципитат HgNH 2 Cl и т. п. Известны два основных типа ртутьорганнческнх соединений: R — Hg — R ‘ н R — HgX , где R и R ‘ — органические радикалы, X —кислотный остаток. Этн соединения могут быть получены прн взаимодействии солей ртути с магний- нли литийорганнческими соединениями при замещении в органических соединениях водорода ртутью (меркуриро-вание), путем прнсоедннення солей ртутн к ненасыщенным соединениям н, наконец, разложением солей дназония в присутствии солей ртути (реакция Несмеянова).
При растворении металлов в ртутн образуются амальгамы (амальгамированию подвержены только металлы, смачиваемые ртутью). Они не отличаются от обычных сплавов, хотя прн избытке ртути представляют собой полужидкие смеси. Прн этом амальгамы могут быть либо обыкновенными (истинными) растворами ( Sn , Pb ) и смесями ( Zn , Cd ), либо химическими соединениями (элементы I группы). По взаимодействию с ртутью металлы можно условно разделить на пять групп:
— металлы, растворимость которых точно не установлена (Та, Si , Re , W , Sb );
— металлы, практически нерастворимые в ртути [растворимость не выше 2- Ю- 5 % (по массе): Cr , Со, Fe , V, Be ];
— металлы с очень низкой растворимостью (на уровне металлов, указанных выше), но образующие с ней химические соединения ( Ni , Ti , Mo , Мп, U );
— металлы, не реагирующие с ртутью прн обычных температурах
но взаимодействующие с ней при повышенных температурах или после предварительного измельчения ( Al , Си, Hf , Ge );
— металлы, образующие с ртутью твердые растворы, а некоторые из них и химические соединения.
Соединения, получающиеся в результате амальгамирования, легко разлагаются ниже температуры их плавления с выделением избытка ртути.
Диаграммы состояния Au — Hg , Ag — Hg , Pt — Hg и Sn — Hg имеют характерные переходные точки, соответствующие разложению химических соединений, образующихся прн амальгамировании в различных температурных условиях. С этими соединениями ртуть образует ряд металлических соединений Стали, легированные углеродом, кремнием, хромом, никелем, молибденом и ниобием, не амальгамируются.
Ртуть широко применяется прн изготовлении различных приборов (барометры, термометры, манометры, вакуумные насосы, нормальные элементы, полярографы, электрометры и др.); в ртутных лампах, переключателях, выпрямителях; как жидкий катод в производстве едких щелочей и хлора электролизом; в качестве катализатора прн синтезе уксусной кислоты; в металлургии для амальгамирования золота и сребра; при изготовлении взрывчатых веществ (гремучая ртуть); в медицине (каломель, сулема, ртутьоргаиическне и другие соединения); в качестве пигмента (киноварь); в сельском хозяйстве в качестве протравителя семян и гербицида (органические соединения ртутн); в судостроении для окраски (компонент краски) морских судов, а также в медицинской практике.
http://mykonspekts.ru/2-71893.html
http://ibrain.kz/ru/himiya-svoystva-elementov/rtut