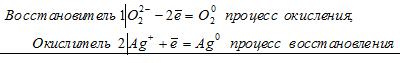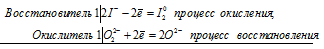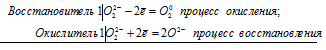«Метод полуреакций, или электронно-ионного баланса»
Разделы: Химия
Тема: метод полуреакций или электронно-ионного баланса
Цель: расширить и углубить знания об ОВР.
Задачи:
- научить определять возможность протекания ОВР между данными веществами;
- научить устанавливать продукты реакции с опорой на схемы;
- раскрыть сущность метода полуреакций;
- рассмотреть правила и алгоритмы составления уравнений ОВР;
- научить применять полученные знания для решения конкретных задач.
Формы обучения: разъяснение, рассуждение, общая характеристика.
Методы обучения: словесные (беседа, объяснение), наглядные (компьютерные), практические (упражнения).
Общедидактические методы: объяснительно-иллюстративный, частично-поисковый, проблемный.
Ход урока.
1. Проверка домашнего задания.
Опрос у доски:
1) Самостоятельная работа у доски : определите тип следующих ОВР:
Подготовка устного ответа: классификация ОВР.
2) Самостоятельная работа у доски: расставить коэффициенты методом электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления:
3) Устный ответ: теория ОВР.
2. Новый материал.
Сегодня на уроке мы познакомимся со способами прогнозирования продуктов в ОВР и новом методе расстановки коэффициентов в ОВР – методе полуреакций или электронно-ионного баланса.
Чтобы написать уравнение реакции, протекающей в смеси заданных веществ, нужно ответить на следующие вопросы:
а) возможна ли в принципе ОВР между данными веществами;
б) если да, то установить продукты реакции;
в) подобрать коэффициенты в уравнении реакции.
Рассмотрим эти вопросы по порядку.
Что касается первого из них, вспомним, что в любой ОВР один из участников окисляется, т.е. повышает свою валентность, а другой – восстанавливается, т.е. понижает валентность. Поэтому реакция невозможна, если оба ее участника находятся в состояниях наиболее высокой или наиболее низкой степени окисления.
Исходя из сказанного, попробуем предположить возможность протекания ОВР.
Например, определим возможна ли ОВР между 
Определите степени окисления элементов.
Учащиеся определяют степени окисления элементов по формулам соединений. Рассматривают строение атомов серы и хлора, определяют высшую и низшую степень окисления элементов.
Формулируем вывод: степени окисления серы (-2) и хлора (-1) являются для них предельно низкими, следовательно, и сера, и хлор могут выступать только в роли восстановителя. Т.е. реакция между 
Рассмотрим другой пример. Возможно ли взаимодействие между ионами 
Учащиеся рассматривают степени окисления марганца и хрома в ионах, определяют исходя из строения атомов, что оба металла находятся в высшей степени окисления, следовательно, могут выступать только в роли окислителя. Делают вывод: реакция между ионами 

Если же один из участников может повысить, а другой понизить свои степени окисления, реакция в принципе возможна.
Указать продукты реакции только из общих соображений в таких реакциях практически невозможно. Исследование химических свойств элементов как раз и представляет собой экспериментальное выяснение того, при каких условиях его соединения вступают в реакцию с другими элементами и соединениями и какие продукты при этом получаются.
Часто в ОВР участвуют соединения хрома и марганца. Особый интерес представляет поведение пероксида водорода в ОВР. Для прогнозирования продуктов реакций с их участием можно использовать следующие схемы.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 1).
Что касается собственно процедуры подбора коэффициентов в уравнениях, то для реакций в растворах удобен так называемый метод полуреакций, или электронно-ионный. В нем сначала записывают и уравнивают отдельно процессы окисления и восстановления, а полная реакция получается их сложением.
Учитель проецирует с помощью видеопроектора схемы на экран, учащиеся для удобства имеют схемы на партах (Приложение 2).
Кроме алгоритма составления полуреакций, необходимо придерживаться нескольких очевидных правил:
- В кислой среде ни в левой, ни в правой части не должно быть ионов
Уравнивание осуществляется за счет ионов
и молекул воды.
- В щелочной среде ни в левой, ни в правой части не должно быть ионов
. Уравнивание осуществляется за счет ионов
и молекул воды.
- В нейтральной среде ни ионов
, ни
в левой части быть не должно. Однако в правой части среди продуктов реакции они могут появиться.
Рассмотрим, как работают предложенные схемы на конкретных примерах.
Задача. Закончить уравнение реакции между бихроматом калия и соляной кислотой.
Ион 
Полуреакция восстановления:
Ионы 
Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой.
Получили сокращенное ионное уравнение.
Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым.
В данном случае источником ионов 






В результате получаем:
После этого можно объединить ионы в формулы реальных веществ:
Рассмотрим другой пример.
Задача. Закончить уравнение реакции 
Ион 
Полуреакция восстановления:
Если ион 
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
, ни
в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов:
- Перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
— его удвоенный коэффициент:
- Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Суммируем сначала левые, а затем правые части полуреакций, не забывая предварительно умножить множитель на коэффициент, если он стоит перед формулой:
- Сокращаем в правой и левой части одинаковые молекулы и ионы:
Таким образом, получаем ионное уравнение.
- Добавляем недостающие катионы или анионы, учитывая, что количество добавляемых ионов в правую и левую части ионного уравнения должно быть одинаковым:
Также рассмотрим пример ОВР, протекающей с щелочной среде.
Задача. Закончить уравнение реакции:
Определяем окислитель и восстановитель в данной ОВР. В нитрате ртути (II) ртуть содержится в ее высшей степени окисления, следовательно, может выступать только в роли окислителя. Составим полуреакцию восстановления.
Полуреакция восстановления:
- Если ион
будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
- Оформляем уравнение ОВР, протекающей в щелочной среде:
- Добавляем недостающие катионы и анионы.
Преимущества электронно-ионного метода при составлении уравнений реакций и подборе коэффициентов в сравнении с методом электронного баланса особенно проявляются при составлении уравнений реакций с участием органических соединений.
Задача. Составьте уравнение окисления ацетилена раствором 
Составляем схему реакции:

Следовательно, схема полуреакции восстановления имеет вид:
Схема полуреакции окисления:
Оформляем уравнение ОВР, протекающей в нейтральной среде:
- Т.к в нейтральной среде ни ионов
, ни
в левой части быть не должно, значит, для уравнивания атомов кислорода в правую часть добавляем воду:
- Оформление полуреакции становится подобным оформлению полуреакции в щелочной среде: в противоположную часть добавляем удвоенное число гидроксид-ионов. Перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
его удвоенный коэффициент. Подсчитываем заряды в полуреакциях, уравниваем заряд. Балансируем (уравниваем) число отданных и принятых электронов в полуреакциях:
- Составляем ионное уравнение:
- Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионы:
Задача. Составьте уравнение реакции окисления фенола дихроматом калия в кислой среде до хинона:
Ион 

Используем правила оформления уравнений ОВР, протекающих в кислотной среде.

Сокращаем в правой и левой части одинаковые молекулы, добавляем недостающие катионыи анионы:
Рассмотрев метод электронно-ионного баланса или метод полуреакций можно выделить следующие достоинства данного метода:
- Рассматриваются реально существующие ионы и вещества.
- Не нужно знать все получающиеся вещества, они появляются в уравнении реакции при его выводе.
- Необязательно знать степени окисления. Понятие степени окисления в органической химии употребляется реже, чем о неорганической химии.
- Этот метод дает сведения не только о числе электронов, участвующих в каждой полуреакции, но и о том, как изменяется среда.
- Сокращенные ионные уравнения лучше передают смысл протекающих процессов и позволяют делать определенные предположения о строении продуктов реакции.
Домашнее задание: Закончить уравнения:
В качестве проверочной работы по изученной теме предлагаю учащимся лабораторные опыты. Учащимся необходимо провести ОВР, объяснить происходящие явления, составив уравнения реакций с помощью метода полуреакций.
Лабораторные опыты «Окислительно-восстановительные реакции»
В три стакана налейте малиновый раствор перманганата калия. Добавьте в первый стакан немного раствора серной кислоты, во второй – воду, в третий – концентрированный раствор гидроксида калия. Окраска растворов при этом не изменяется. Добавьте во все стаканы по 5 мл сульфита калия и хорошо перемешайте смеси стеклянной палочкой.
Задание: объясните изменение окраски растворов, составив ОВР методом полуреакций.
Литература:
Д.Д. Друзцова, Л.Б. Бестаева Окислительно-восстановительные реакции. – М.:Дрофа,2005.
Эксперимент с перекисью водорода и йодидом калия
Смешаем пероксид водорода Н2О2 с калий йодидом KI. Получим реакцию с изменением цвета и объема.
Оба соединения используются в лечебных целях, но в большой концентрации наносят вред организму. Так, перекись водорода применяется как местный антисептик и кровоостанавливающее средство при оказании первой медицинской помощи, но раствор в концентрации 35% приводит к ожогам кожи, слизистых оболочек, дыхательных путей. Калий йодид в кристаллах лечит йододефицитные состояния, защищает щитовидную железу от радиации, применяется в качестве пищевой добавки для обогащения поваренной соли. Чрезмерное потребление приводит к йодизму: симптомы включают головную боль, депрессию, насморк, сыпь, слабость. В детском эксперименте используем вещества в слабых концентрациях: меньше зрелищности, зато соблюдение техники безопасности.
Материалы:
- пустой стакан;
- перекись водорода 3%;
- жидкое мыло или шампунь;
- йодид калия 2% в каплях;
- пищевой краситель или краски;
- палочка для размешивания;
- подставка (поднос).
Ход работы:
Налейте в стакан 30-50 мл перекиси водорода. Добавьте немного моющего средства. Подкрасьте, размешайте.
Далее залейте йодид калия. Произойдут интересные преобразования: выделится йод и окрасит раствор в желто-коричневый цвет. А также перекись водорода разложится на воду и кислород — пузырьки увеличат объем смеси. Йодид калия ускорит химический процесс – получим густой слой мыльной пены сверху.
Если бы мы использовали максимальные концентрации веществ, реакция была бы очень бурной – с выделением огромного и быстрого столба пены из стакана.
Пероксид водорода в окислительно-восстановительных реакциях
Решение задач по химии на составление уравнений реакций окисления-восстановления на примере пероксида водорода
Задание 325.
Какие свойства может проявлять пероксид водорода в окислительно-восстановительных реакциях? На основании электронных уравнений напишите уравнения реакций Н2О2: а) с Аg2O;б) с КI.
Решение:
В пероксиде водорода Н2О2 кислород находится в своей промежуточной степени окисления -1, поэтому в зависимости от условий он может быть как восстановителем (когда увеличивает свою степень окисления атом кислорода), так и окислителем (когда атом кисло-рода уменьшает свою степень окисления). Например:
Здесь в пероксиде атом кислорода увеличивает свою степень окисления от -1 до 0, т.е. Н2О2 – восстановитель.
Здесь в пероксиде атом кислорода уменьшает свою степень окисления от -1 до -2, т.е. Н2О2 – окислитель.
Задание 326
Почему пероксид водорода способен диспропорционировать (самоокисляться-самовосстанавливаться)? Составьте электронные и молекулярные уравнения процесса разложения Н2О2.
Решение:
Реакции самоокисления-самовосстановления (реакции диспропорционирования, дисмутации) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента в соединении. Поэтому эти реакции принципиально осуществимы лишь для тех соединений, в молекулах которых есть атомы со степенью окисления промежуточной между минимально и максимально возможной. Например, реакция самоокисления-самовосстановления:
В пероксиде водорода Н2О2 атом кислорода находится в своей степени окисления -1, про-межуточной между максимальной (0) и минимальной (-2).
http://childdevelop.ru/practice/experiments/10793/
http://buzani.ru/zadachi/khimiya-shimanovich/973-peroksid-vodoroda-zadachi-325-326


 Уравнивание осуществляется за счет ионов
Уравнивание осуществляется за счет ионов 









 ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед
ставим коэффициент, показывающий разницу в числе атомов кислорода в правой и левой частях полуреакций, а перед 






 будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде:
будет выступать в роли окислителя, то пероксид водорода — в роли восстановителя. По схеме составляем полуреакцию восстановления пероксида водорода в щелочной среде: