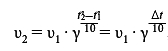Расчёты по термохимическим уравнениям
Теоретический материал представлен на страницах:
Любая химическая реакция сопровождается поглощением или выделением энергии. Термохимические уравнения показывают соотношение между кол-вом веществ, вступающих в реакцию, и кол-вом энергии, которую выделяют, либо поглощают эти вещества в процессе химической реакции.
Главное отличие термохимического уравнения от молекулярного заключается в том, что кроме формул и коэффициентов, в нем указывается еще и кол-во энергии (теплоты реакции), относящееся к числу молей реагирующих веществ, соответствующему коэффициентам в уравнении реакции.
Теплота реакции (тепловой эффект) обозначается буквой Q (измеряется в кДж), и записывается в конце уравнения. Знак «плюс» перед числом обозначает выделившееся кол-во энергии, знак «минус» — кол-во поглощенной энергии.
Реакции, протекающие с выделением энергии, называются экзотермическими; с поглощением энергии — эндотермическими.
Если известна масса одного из двух реагирующих веществ, на основе термохимического уравнения можно определить кол-во теплоты реакции.
Пример 1 . Определить теплоту реакции горения 320 г серы.
- Согласно уравнения реакции, при сгорании 1 моля серы выделяется 297 кДж энергии, нам надо узнать, сколько энергии выделится при сгорании 320 г серы.
- Для решения задачи необходимо составить и решить простую пропорцию:
- Переходим от молей к граммам:
- В пропорции заменяем моли на граммы:
Если известно кол-во выделенной (поглощенной) теплоты в ходе реакции, можно определить массы прореагировавших веществ.
Пример 2 . Определить кол-во сгоревшего угля, если в ходе горения было выделено 33520 кДж энергии.
- Согласно уравнения реакции, при сгорании 1 моль углерода (масса 1 моль С = 12 г) выделилсь 402,24 кДж энергии.
- Составляем и решаем пропорцию:
Пример 3 . При горении 1 л метана (н.у) выделяется 39 кДж энергии. Составить термохимическое уравнение реакции и вычислить тепловой эффект.
Пример 4 . При горении 2,4 г магния (н.у) выделяется 60,12 кДж энергии. Составить термохимическое уравнение реакции.
Пример 5 . Два моля аммиака образуются в результате взаимодействия 1 моля азота с тремя молями водорода. Необходимо составить уравнение термохимической реакции, в ходе которой выделяется 92 кДж тепла, а все вещества, участвующие в реакции, являются газами.
Это очень простая задача, решение которой указано в условии.
Второй вариант записи термохимического уравнения.
Пример 6 . Составить термохимическое уравнение эндотермической реакции образования двухвалентного оксида азота из азота и кислорода с поглощением 180 кДж энергии. Записать это уравнение для образования 1 моля NO.
Первая часть задания не вызывает трудностей:
В этом термохимическом уравнении 2 моля оксида азота образуется при взаимодействии 1 моля азота и 1 моля кислорода. Для того, чтобы переписать данное уравнение для 1 моля оксида азота, необходимо все коэффициенты и кол-во теплоты разделить на 2:
Пример 7 . При образовании 50 г карбоната кальция (CaCO3) выделилось 80 кДж энергии. Определить тепловой эффект реакции разложения одного моля карбоната кальция.
- Определяем кол-во энергии, выделяемое при образовании 1 моля CaCO3 (М(CaCO3)=100 г/моль):
- Термохимическое уравнение реакции образования 1 моль карбоната кальция имеет вид:
- Термохимическое уравнение реакции разложения 1 моль карбоната кальция имеет вид:
- Q=-160 кДж
Пример 8 . Рассчитать кол-во выделенной энергии при образовании 2 л аммиака при н.у.
- Согласно термохимического уравнения — 1 моль аммиака образовался из полумоля азота и полутора молей водорода. Составляем пропорцию:
Пример 9 . Рассчитать тепловой эффект реакции:
- На основании первого следствия из закона Гесса:
- Теплоты образования простых веществ равны нулю:
- Теплоты образования сложных веществ берем из таблицы:
- Подставляем числовые значения в уравнение:
- Термохимическое уравнение реакции будет иметь вид:
Пример 10 . Рассчитать тепловой эффект реакции:
- Тепловой эффект реакции будем рассчитывать по формуле, вытекающей из второго следствия закона Гесса:
- Тепловые эффекты сгорания C2H4 и C2H6 можно взять из приведенных выше термохимический уравнений.
- Тепловой эффект сгорания водорода можно вычислить из термохимического уравнения образования 1 моля воды (теплоту образования воды берем из таблицы):
- Подставляем численные значения в формулу:
- Термохимическое уравнение реакции будет иметь вид:
Пример 11 . Определить скорость изменения реакции синтеза аммиака при а) увеличении концентрации исходных веществ в 2 раза; б) уменьшении давления в реакционной смеси в 2 раза:
- Записываем кинетическое уравнение данной реакции:
- Если концентрации исходных веществ будут увеличены в 2 раза, кинетическое уравнение примет вид:
- Составляем отношение и решаем его:
- Увеличение концентрации исходных веществ в 2 раза приведет к ускорению скорости реакции в 16 раз.
- Исходя из того факта, что концентрации газов пропорциональны давлению (при уменьшении давления в 2 раза концентрации также уменьшатся в 2 раза), логично предположить, что при снижении в 2 раза давления скорость протекания реакции снизится в 16 раз. Убедимся в этом, составив соотношение кинетических уравнений.
- Исхдное кинетическое уравнение:
- Для удобства чтения формул сделаем подстановку:
- Кинетическое уравнение при снижении давления в 2 раза:
- Соотошение:
- При уменьшении давления в реакционной смеси в 2 раза скорость протекания реакции уменьшится в 16 раз.
Пример 12 . Определить скорость изменения реакции с температурным коэффициентом 4 (γ=4) при повышении температуры с 10°C до 30°C.
Для решения задачи воспользуемся правилом Вант-Гоффа, которое выражается следующей математической формулой:
Все, что нам нужно сделать — подставить численные значения в формулу и провести расчеты:
При повышении температуры с 10 до 30 градусов Цельсия скорость реакции увеличится в 16 раз.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Типовые задания с решениями ЕГЭ по химии: задачи, при решении которых необходимо осуществить расчеты по термохимическим уравнениям реакций.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Типовые задания с решениями ЕГЭ по химии: задачи, при решении которых необходимо осуществить расчеты по термохимическим уравнениям реакций.
Умение решать расчётные задачи является одним из основных показателей уровня химического развития, глубины и полноты усвоения учащимися теоретического материала, наличия у них навыков приобретённых знаний с достаточной самостоятельностью.
Проверяемый элемент содержания заданий ЕГЭ включает расчеты объемных отношений газов при химических реакциях, а так же расчеты по термохимическим уравнениям реакций. В данной статье будут рассмотрены задачи второго типа.
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Между количеством теплоты, выделившимся или затраченным в ходе химической реакции, и количеством веществ, участвующих в этой реакции, существует прямо пропорциональная зависимость:
Величина постоянная для данной реакции.
Любая величина из пропорции может быть неизвестной. Задачи решаются методом пропорции.
Например: Термохимическое уравнение разложения малахита
Мы видим, что на разложение 1 моля малахита необходимо израсходовать 47 кДж, при этом образуется 2 моля оксида меди, 1 моль воды и 1 моль углекислого газа. Если мы затратим энергии в 2 раза больше, мы сумеем разложить 2 моля малахита, при этом получим 4 моля оксида меди, 2 моля воды и 2 моля углекислого газа.
Аналогично можно установить пропорциональные отношения, используя коэффициенты и молярные массы участников реакции. 47 кДж энергии затратится на разложение 94 г малахита, при этом выделится 160 г оксида меди, 18 г воды и 44 г углекислого газа. Пропорция несложная, но, используя массовые числа, учащиеся часто допускают расчетные ошибки, поэтому рекомендуется решать задачи с пропорциями через количество вещества.
Алгоритм решения задач
Данные из условия задачи написать над уравнением реакции
Под формулой вещества написать его количество (согласно коэффициенту); произведение молярной массы на количество вещества. Над количеством теплоты в уравнении реакции поставить х.
Сколько теплоты выделится при растворении 200 г оксида меди ( II ) (С uO ) в соляной кислоте (водный раствор HCl ), если термохимическое уравнение реакции: CuO + 2 HCl = CuCl 2 + H 2 O + 63,6 кДж
Последовательность выполнения действий
Оформление решения задачи
1.С помощью соответствующих обозначений запишем условие задачи, найдём молярную массу вещества, масса которого указана в условии задачи.
М(С uO ) = 80 г/моль
2. Найдём количество вещества оксида меди ( II ) по условию задачи.
n = m /М n = 200г/80 г/моль = 2,5 моль
3.Составим уравнение реакции. Над формулами веществ запишем найденные количества веществ, а под формулами – молярные соотношения по уравнению реакции
CuO + 2 HCl = CuCl 2 + H 2 O + 63,6 кДж
4. Составим пропорцию.
5. Найдём значение х
6. Запишем ответ.
Задачи на вычисления по термохимическим уравнениям. Типовые задачи и решения.
Количество теплоты, которое выделится при образовании 120 г MgO в результате реакции горения магния, термохимическое уравнение которой:
2 Mg + O 2 = 2 MgO + 1204 кДж , равно
а) 602 кДж б) 301 кДж в) 2408 кДж г) 1803 кДж
В реакцию, термохимическое уравнение которой S + O 2 = SO 2 + 297 кДж, вступила сера массой 1 г. Количество теплоты, выделившееся при этом, равно:
а) 9,28 кДж б) 2,97 кДж в) 29,7 1 кДж г) 74,25 кДж
Какое количество теплоты выделится при сгорании графита массой 2,4 г, если термохимическое уравнение реакции C + O2 = CO2 + 402 кДж?
а) 984 кДж б) 40,2 кДж в) 98,4 кДж г) 80,4 кДж
Термохимическое уравнение горения фосфора: 4P + 5O2 = 2P2O5 + 3010 кДж. Какое количество теплоты выделится при сгорании 62 г фосфора?
а) 6020 кДж б) 752,5 кДж в) 301кДж г) 1505 кДж
Какое количество теплоты выделится при сгорании метана объемом 5,6 л (н.у.), если термохимическое уравнение реакции СН 4 + 2О 2 = СО 2 + 2Н 2 О + 892 кДж?
а) 22,3 кДж б) 2,23 кДж в) 223 кДж г) 446 кДж
Сколько теплоты выделится при растворении 200 г оксида меди ( II ) (С uO ) в соляной кислоте, если термохимическое уравнение реакции: CuO + 2 HCl = CuCl 2 + H 2 O + 63,6 кДж
а) 159 кДж б) 318 кДж в) 15,9кДж г) 636 кДж
В результате реакции, термохимическое уравнение которой
выделилось 652,5 кДж теплоты. Масса сгоревшего ацетилена составила:
а) 13 г б) 26 г в) 52г г) 5,2г
В результате горения 48 г метана выделилось 2406 кДж теплоты. Количество теплоты, указанное в термохимическом уравнении этой реакции составит:
а) 401 кДж б) 802 кДж в) 1203кДж г) 4812 кДж
На разложение бертолетовой соли по реакции, термохимическое уравнение которой
2 KClO 3 = 2 KCl + 3 O 2 – 91 кДж,
было затрачено 182 кДж теплоты. Объем кислорода (при н.у.) выделившийся при этом, составил:
а) 134,4л б) 44,8л в) 89,6л г) 179,2л
В результате реакции, термохимическое уравнение которой H 2 + Cl 2 = 2 HCl + 184,36 кДж, выделилось 921,8 кДж теплоты. Объем хлора, затраченный на образование хлороводорода (при н.у.) при этом составил:
а) 134,4л б) 112л в) 44,8л г) 96л
Согласно термохимическому уравнению реакции 2СО(г) + О2(г) = 2СО2(г) + 566 кДж при сжигании оксида углерода (II) выделилось 424,5 кДж теплоты. Объем (н.у.) сгоревшего газа составил
а) 66,2 л б) 33,6 л в) 44,8 л г) 12 л
Согласно термохимическому уравнению реакции 3 Cu + 8 HNO 3 = 3 Cu ( NO 3)2 + 2 NO + 4 H 2 O + 385 кДж, при получении 15,68 л NO (н.у.), количество выделившейся теплоты составило:
а) 358 кДж б) 716 кДж в) 134,75 кДж г) 22,4 кДж
По термохимическому уравнению реакции 2С u + О2 = 2С u О + 311 кДж вычислите. Количество теплоты, которая выделится при окислении 384 г меди, составит:
а) 622 кДж б) 716 кДж в) 466,5 кДж г) 933 кДж
В результате реакции, термохимическое уравнение которой
2 Cl 2 O 7 = 2 Cl 2 + 7 O 2 + 574 кДж, выделилось 5,74 кДж теплоты. Объем образовавшегося при этом кислорода (н.у.) составил:
а) 100 л б) 0,224 л в) 1,568 л г) 4,48 л
В реакцию, термохимическое уравнение которой MgO (тв) + CO (г) = MgCO 3(тв) + 102 кДж, вступило 8 г оксида магния. Количество теплоты, выделившейся при этом, равно:
а) 102 кДж б) 204 кДж в) 20,4 кДж г) 1,02 кДж
Задания 28. Расчеты объемных отношений газов при химической реакции. Тепловой эффект.
В результате реакции, термохимическое уравнение которой
выделилось 1452 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах). (Запишите число с точностью до целых.)
Ответ: 108
Пояснение:
Из уравнения реакции следует, что при образовании 2 моль воды выделяется 484 кДж теплоты. У нас же выделилось 1452 кДж теплоты. Составим пропорцию
2 моль H2O — 484 кДж
x моль H2O — 1452 кДж
2 : x = 484 : 1452
x = 2 ∙ 1452 /484 = 6
т.е. n(H2O) = 6 моль, следовательно:
При взаимодействии оксида серы (IV) с 5,6 л (н.у.) кислорода в соответствии с уравнением
выделилось 19 кДж теплоты. Определите тепловой эффект реакции. (Запишите число с точностью до целых.)
Ответ: 76
Пояснение:
Рассчитаем количество вещества кислорода:
Т.е. при взаимодействии 0,25 моль кислорода с оксидом серы (IV) выделяется 19 кДж теплоты. Из представленного в условии термохимического уравнения следует, что при взаимодействии 1 моль кислорода с оксидом серы выделяется количество теплоты равное Q (тепловой эффект реакции). Тогда справедлива пропорция:
0,25 моль кислорода — 19 кДж
1 моль кислорода — Q
Исходя из этой пропорции:
Таким образом, тепловой эффект реакции составляет 76 кДж.
В соответствии с термохимическим уравнением реакции
выделилось 786 кДж теплоты. Какой объем (н.у.) углекислого газа при этом образовался? (Запишите число с точностью до десятых.)
Ответ: 44,8
Пояснение:
В соответствии с термохимическим уравнением реакции при образовании 1 моль углекислого газа выделяется 393 кДж теплоты. В нашем же случае вместо этого выделилось 786 кДж теплоты. Обозначив искомое количество вещества углекислого газа равным х моль, можно записать пропорцию:
1 моль CO2 — 393 кДж теплоты
x моль CO2 — 786 кДж теплоты
Следовательно, справедливо уравнение:
Решая которое получаем:
Т.е. количество вещества углекислого газа при образовании которого выделяется 786 кДж теплоты составляет 2 моль.
Рассчитаем объем такого количества углекислого газа при н.у.:
V(CO2) = 2 моль ∙ 22,4 л/моль = 44,8 л
В соответствии с термохимическим уравнением реакции
выделилось 2406 кДж теплоты. Определите объем (н.у.) израсходованного кислорода в литрах. (Запишите число с точностью до десятых.)
Ответ: 134,4
Пояснение:
Согласно термохимическому уравнению при участии в реакции горения метана 2 моль кислорода выделяется 802 кДж теплоты. В нашем же случае выделяется количество теплоты равное 2406 кДж. Обозначив количество вещества кислорода необходимое для выделения 2406 кДж теплоты через х моль мы можем записать следующую пропорцию:
2 моль O2 — 802 кДж теплоты
x моль O2 — 2406 кДж теплоты
Тогда, справедливо следующее уравнение:
2 ∙ 2406 = 802 ∙ x
Решая которое находим ,что:
Таким образом, количество вещества кислорода равно 6 моль. Рассчитаем его объем:
V(O2) = 6 ∙ 22,4 = 134,4 л.
Вычислите количество теплоты, которое потребуется для получения 25 г железа согласно уравнению реакции
(Запишите число с точностью до целых.)
Ответ: 6
Пояснение:
Рассчитаем количество вещества железа:
n(Fe) = m(Fe)/M(Fe) = 25/56 = 0,4464 моль,
Согласно термохимическому уравнению при образовании 2 моль металлического железа поглощается 27 кДж теплоты. Пусть количество поглощаемой в результате образования 0,4464 моль железа равно х кДж. Тогда можно записать пропорцию:
2 моль Fe — 27 кДж
0,4464 моль Fe — x кДж
Следовательно, справедливо уравнение:
2 ∙ x = 0,4464 ∙ 27
Таким образом, количество теплоты, которое необходимо для получения 25 г железа равно 6 кДж.
Вычислите объем сгоревшего согласно уравнению реакции
ацетилена, если при этом выделилось 67,5 кДж теплоты. (Запишите число с точностью до сотых.)
Ответ: 1,12
Пояснение:
Согласно термохимическому уравнению при сгорании 2 моль ацетилена выделяется 2700 кДж теплоты. В нашем же случае выделилось 67,5 кДж. Пусть, количество вещества ацетилена, которое сгорело при этом равно х моль. Таким образом можно записать пропорцию:
x моль — 67,5 кДж
2 ∙ 67,5 = 2700 ∙ x
Таким образом, количество вещества ацетилена равно 0,05 моль. Рассчитаем его объем:
V(C2H2) = 0,05 моль ∙ 22,4 л/моль = 1,12 л
В результате реакции, термохимическое уравнение которой
выделилось 280 кДж теплоты. Вычислите массу глюкозы, которая окислилась в результате этой реакции. (Запишите число с точностью до целых.)
Ответ: 18
Согласно термохимическому уравнению при окислении 1 моль глюкозы выделяется 2800 кДж теплоты. В нашем же случае выделилось 280 кДж теплоты. Пусть количество глюкозы, которое окислилось при этом равно x моль. Тогда можно записать следующую пропорцию:
1 моль глюкозы – 2800 кДж теплоты
x моль глюкозы – 280 кДж теплоты
Следовательно, справедливо уравнение:
1 ∙ 280 = 2800 ∙ x
Решая которое находим, что:
x = 0,1 моль, т.е. количество глюкозы составляет 0,1 моль. Рассчитаем ее массу:
Какое количество вещества аммиака вступает в реакцию в соответствии с термохимическим уравнением
если в результате реакции выделилось 634 кДж теплоты? (Запишите число с точностью до целых.)
Ответ: 2
Пояснение:
Согласно термохимическому уравнению при окислении 4 моль аммиака выделяется 1268 кДж теплоты. В нашем же случае выделилось 634 кДж теплоты. Обозначим количество вещества аммиака, которое при этом окислилось как x моль. Тогда можно записать пропорцию:
4 моль аммиака – 1268 кДж
x моль аммиака – 634 кДж
Следовательно, справедливо уравнение:
4 ∙ 634 = 1268 ∙ x
Решая которое находим, что:
x = 2, т.е. количество вещества аммиака составляет 2 моль.
В соответствии с термохимическим уравнением реакции
получено 1400 кДж теплоты. Какая масса (в граммах) глюкозы при этом окислилась? (Запишите число с точностью до целых.)
Ответ: 90
Пояснение:
Согласно термохимическому уравнению при окислении 1 моль глюкозы выделяется 2800 кДж теплоты. В нашем же случае выделилось 1400 кДж теплоты. Пусть количество глюкозы, которое окислилось при этом равно x моль. Тогда можно записать следующую пропорцию:
1 моль глюкозы – 2800 кДж теплоты
x моль глюкозы – 1400 кДж теплоты
Следовательно, справедливо уравнение:
1 ∙ 1400 = 2800 ∙ x
x = 0,5, т.е. количество вещества глюкозы для получения 1400 кДж тепла составляет 0,5 моль. Рассчитаем ее массу:
В соответствии с термохимическим уравнением реакции
выделилось 240 кДж теплоты. Определите массу полученного оксида магния. (Запишите число в точностью до целых.)
Ответ: 16
Пояснение:
Согласно термохимическому уравнению при образовании 2 моль оксида магния выделяется 1200 кДж теплоты. В нашем же случае выделилось 240 кДж теплоты. Пусть количество оксида магния, образовавшегося при этом равно x моль. Тогда можно записать пропорцию:
2 моль MgO – 1200 кДж
x моль MgO – 240 кДж
Следовательно, справедливо уравнение:
2 ∙ 240 = 1200 ∙ x
Решая которое находим, что:
x = 0,4, т.е. при выделении 240 кДж теплоты количество вещества образовавшегося оксида магния составляет 0,4 моль. Тогда его масса равна:
m(MgO) = n(MgO) ∙ M(MgO) = 0,4 ∙ 40 = 16 г
В ходе реакции, термохимическое уравнение которой
было затрачено 450 кДж теплоты. Определите объем (н.у.) получившегося при этом газа. (Запишите число с точностью до целых.)
Ответ: 56
Пояснение:
Выделившийся газ – CO2.
В соответствии с термохимическим уравнением при образовании одного моля CO2 поглощается 180 кДж теплоты. В нашем же случае поглощено 450 кДж теплоты. Обозначив количество вещества углекислого газа, образовавшегося при этом как x моль, можно записать следующую пропорцию:
1 моль CO2 – 180 кДж
x моль CO2 – 450 кДж
Следовательно, справедливо уравнение:
x = 2,5, т.е. количество вещества углекислого газа составляет 2,5 моль. Рассчитаем его объем:
В соответствии с термохимическим уравнением реакции
образовалось 168 г железа. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Ответ: 1110
Пояснение:
Рассчитаем количество вещества железа с массой 168 г:
n(Fe) = m(Fe)/M(Fe) = 168/56 = 3 моль,
В соответствии с термохимическим уравнением реакции при образовании 9 моль металлического железа выделяется 3330 кДж. В нашем же случае образуется 3 моль железа. Обозначив количество теплоты выделившейся при этом как x кДж можно составить пропорцию:
9 моль Fe — 3330 кДж
3 моль Fe — x кДж
тогда справедливо уравнение:
Таким образом, количество теплоты выделяющееся при образовании 168 г металлического железа составляет 1110 кДж.
Определите количество теплоты, которое выделится при взаимодействии 280 г негашеной извести с водой в соответствии с термохимическим уравнением реакции
(Запишите число с точностью до целых.)
Ответ: 324
Пояснение:
Негашеная известь — тривиальное название оксида кальция CaO. Рассчитаем его количество вещества, зная массу:
n(CaO) = 280 г/ 56 г/моль = 5 моль,
В соответствии с термохимическим уравнением реакции при взаимодействии с водой 1 моль CaO выделяется количество теплоты равное 64,8 кДж. В нашем же случае в реакции принимает участие 5 моль оксида кальция, в связи с чем мы можем записать следующую пропорцию:
1 моль CaO — 64,8 кДж
5 моль CaO — x кДж
Следовательно, справедливо уравнение:
Решая которое находим, что:
Таким образом, количество теплоты, которое выделится при взаимодействии 280 г негашеной извести водой составляет 324 кДж.
В результате реакции, термохимическое уравнение которой
выделилось 6620 кДж теплоты. Определите массу образовавшегося оксида железа (III). (Запишите число с точностью до целых.)
Ответ: 640
Пояснение:
В соответствии с термохимическим уравнением реакции при образовании 2 моль Fe2O3 выделяется 3310 кДж теплоты. В нашем же случае, выделилось 6620 кДж теплоты. Пусть количество вещества Fe2O3, образовавшегося при этом составляет x моль. Тогда можно записать следующую пропорцию:
Следовательно, справедливо уравнение:
2 ∙ 6620 = x ∙ 3310
Решая которое находим, что:
Таким образом, количество вещества Fe2O3 образовавшееся при этом составляет 4 моль. Следовательно масса образовавшегося Fe2O3 составляет:
При образовании 560 мл (н.у.) газообразного аммиака в соответствии с уравнением
выделилось 1,15 кДж теплоты. Чему равен тепловой эффект этой реакции? (Запишите число с точностью до целых.)
Ответ: 92
Пояснение:
Посчитаем какое количество вещества содержится в 560 мл газообразного аммиака. Прежде всего переведем его объем из мл в л:
Теперь, зная, что 1 моль любого газа при н.у. занимает объем равный 22,4 л, можно рассчитать количество вещества аммиака:
Из условия задания следует, что при образовании 0,025 моль (0,56 л) аммиака выделилось 1,15 кДж теплоты. В термохимическом же уравнении реакции фигурирует количество вещества аммиака равное 2 моль (коэффициент 2 перед NH3) и при этом выделяется количество тепла, равное Q (тепловой эффект реакции). Таким образом, мы можем записать следующую пропорцию:
0,025 моль — 1,15 кДж
Следовательно справедливо уравнение:
0,025 ∙ Q = 2 ∙ 1,15 кДж
Решая которое находим, что:
Т.е. тепловой эффект реакции равен 92 кДж.
В соответствии с термохимическим уравнением реакции
восстановили 464 г железной окалины. Какое количество теплоты при этом выделилось? (Запишите число с точностью до целых.)
Ответ: 2220
Пояснение:
Рассчитаем количество вещества железной окалины массой 464 г:
В соответствии с термохимическим уравнением реакции при восстановлении 3 моль Fe3O4 выделяется 3330 кДж теплоты. Пусть при восстановлении 2 моль Fe3O4 выделяется x кДж теплоты. Тогда можно составить следующую пропорцию:
Следовательно, справедливо уравнение:
Решая которое, получаем, что:
Таким образом, количество теплоты, выделившейся при восстановлении 464 г железной окалины составляет 2220 кДж.
В соответствии с термохимическим уравнением реакции
выделилось 2406 кДж теплоты. Определите объем (н.у.) израсходованного кислорода. (Запишите число с точностью до десятых.)
Ответ: 134,4
Пояснение:
В соответствии с термохимическим уравнением реакции при реакции с метаном 2 моль кислорода выделяется 802 кДж. В нашем же случае выделилось 2406 кДж теплоты. Пусть количество вещества израсходованного при этом кислорода составляет x моль. Тогда можно записать пропорцию:
2 моль O2 – 802 кДж
x моль O2 – 2406 кДж
Следовательно, справедливо уравнение:
2 ∙ 2406 = 802 ∙ x
Т.е. количество вещества кислорода составляет 6 моль. Найдем его объем:
В соответствии с термохимическим уравнением реакции
получено 422,2 кДж теплоты. Какой объем (н.у.) кислорода при этом израсходован? (Запишите число с точностью до целых.)
Ответ: 24
Пояснение:
В соответствии с термохимическим уравнением при израсходовании на горение угля 1 моля кислорода выделяется 393 кДж теплоты. В нашем же случае выделяется 422,2 кДж. Пусть при выделении такого количества теплоты расходуется x моль кислорода. Тогда, мы можем записать пропорцию:
1 моль O2 – 393 кДж
x моль O2 – 422,2 кДж
Следовательно, справедливо уравнение:
1 ∙ 422,2 = 393 ∙ x
Решая которое находим, что:
т.е. количество вещества израсходованного кислорода составляет 1,0743 моль. Рассчитаем его объем:
Какой объем (н.у.) кислорода потребуется для получения 5600 кДж теплоты в соответствии с термохимическим уравнением реакции
(Запишите число с точностью до десятых.)
Ответ: 268,8
Пояснение:
Исходя из термохимического уравнения:
6 моль O2 — 2800 кДж теплоты
В нашем же случае должно выделиться 5600 кДж. Пусть количество вещества кислорода необходимое для выделения такого количества тепла составляет x моль. Тогда справедлива пропорция:
6 моль O2 — 2800 кДж теплоты
x моль O2 — 5600 кДж теплоты
Следовательно, верным является уравнение:
6 ∙ 5600 = 2800 ∙ x
Таким образом, количество вещества кислорода, которое должно принять участие в окислении глюкозы для выделения 5600 кДж теплоты, составляет 12 моль. Рассчитаем объем такого количества кислорода при н.у.:
При сжигании ацетилена в соответствии с термохимическим уравнением реакции
выделилось 186 кДж теплоты. Какой объем (н.у.) кислорода затрачен на сжигание ацетилена? (Запишите число с точностью до десятых.)
Ответ: 22,4
Пояснение:
Из термохимического уравнения реакции следует, что когда в реакции принимает участие 5 моль O2 выделяется 930 кДж теплоты.
В нашем же случае выделяется 186 кДж теплоты. Пусть количество вещества кислорода, израсходованного при этом, составляет x моль. Тогда мы можем записать следующую пропорцию:
5 моль O2 – 930 кДж
x моль O2 – 186 кДж
Следовательно, справедливо уравнение:
Решая которое находим, что:
Таким образом, количество вещества кислорода составляет 1 моль. Найдем его объем:
В соответствии с термохимическим уравнением реакции
выделилось 2580 кДж теплоты. Определите количество вещества оксида азота(IV), вступившего в реакцию. (Запишите число с точностью до целых.)
Ответ: 40
Пояснение:
Из термохимического уравнения реакции следует, что когда в реакции принимает участие 4 моль NO2 выделяется 258 кДж теплоты.
В нашем же случае выделяется 2580 кДж теплоты. Пусть количество вещества оксида азота (IV), прореагировавшего при этом, составляет x моль. Тогда мы можем записать следующую пропорцию:
4 моль NO2 – 258 кДж
x моль NO2 – 2580 кДж
Следовательно, справедливо уравнение:
4 ∙ 2580 = x ∙ 258
Решая которое находим, что:
Таким образом, количество вещества оксида азота (IV) составляет 40 моль.
Определите объём газообразного продукта (в литрах), который получается при взаимодействии 1 л водорода с избытком хлора. Объёмы газов измерены при одинаковых условиях. (Запишите число с точностью до целых.)
Ответ: 2
Пояснение:
Запишем уравнение реакции взаимодействия водорода с хлором:
Одним из следствий закона Авогадро является то, что объемы прореагировавших и образовавшихся газов относятся друг к другу точно так же, как и коэффициенты перед этими газообразными веществами в уравнении реакции. Для газообразных водорода и хлороводорода, применительно к нашей реакции, мы можем записать что:
V(HCl) = V(H2) ∙ k(HCl)/k(H2) = 1 л ∙ 2/1 = 2 л
Определите количество теплоты, которое выделяется при окислении серы кислородом взятым в объёме 100,8 л (н.у.) в соответствии с термохимическим уравнением реакции
(Запишите число с точностью до целых.)
Ответ: 1341
Определите количество теплоты, которое выделится при обжиге 720 г FeS2 согласно термохимическому уравнению реакции
(Запишите число с точностью до целых.)
Ответ: 4965
Вычислите количество выделившейся теплоты, если в реакцию вступает 3,5 моль кислорода в соответствии с термохимическим уравнением реакции
(Запишите число с точностью до целых.)
Ответ: 903
Какое количество теплоты выделится при взаимодействии 3,6 моль кремния с фтором в соответствии с термохимическим уравнением реакции
(Запишите число с точностью до целых.)
Ответ: 5814
В реакцию, термохимическое уравнение которой
вступило 88 г углекислого газа. Какое количество теплоты выделится при этом? (Запишите число с точностью до целых.)
http://infourok.ru/tipovye__zadaniya_s_resheniyami_ege_po_himii_zadachi__pri_reshenii_kotoryh_neobhodimo-579331.htm
http://scienceforyou.ru/reshenie-realnyh-zadanij-egje-2016-goda/raschety-obemnyh-otnoshenij-gazov-pri-himicheskoj-reakcii-teplovoj-jeffekt