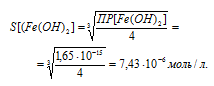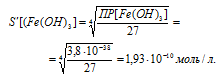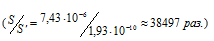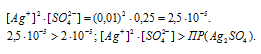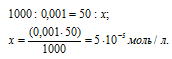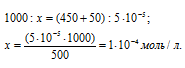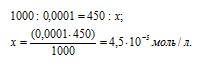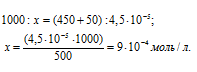Гидроксид железа (II)
Гидроксид железа (II)
Способы получения
1. Гидроксид железа (II) можно получить действием раствора аммиака на соли железа (II).
Например , хлорид железа (II) реагирует с водным раствором аммиака с образованием гидроксида железа (II) и хлорида аммония:
2. Гидроксид железа (II) можно получить действием щелочи на соли железа (II).
Например , хлорид железа (II) реагирует с гидроксидом калия с образованием гидроксида железа (II) и хлорида калия:
FeCl2 + 2KOH → Fe(OH)2↓ + 2KCl
Химические свойства
1. Гидроксид железа (II) проявляется основные свойства , а именно реагирует с кислотами . При этом образуются соответствующие соли.
Например , гидроксид железа (II) взаимодействует с соляной кислотой с образованием хлорида железа (II):
2. Гидроксид железа (II) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (II) взаимодействует с оксидом серы (VI) с образованием сульфата железа (II):
3. Гидроксид железа (II) проявляет сильные восстановительные свойства , и реагирует с окислителями. При этом образуются соединения железа (III) .
Например , гидроксид железа (II) взаимодействует с кислородом в присутствии воды:
Гидроксид железа (II) взаимодействует с пероксидом водорода:
При растворении Fe(OH)2 в азотной или концентрированной серной кислотах образуются соли железа (III):
4. Г идроксид железа (II) разлагается при нагревании :
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1bf0c00e04596b • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Решение задач по химии на вычисление растворимости солей
Задача 567.
Во сколько раз растворимость S (в молы/л) Fe(OH)2 в воде больше растворимости Fe(OH)3 при 25°С?
Решение:
Вычислим сначала растворимость Fe(OH)2. Обозначим искомую растворимость Fe(OH)2 через S моль/л. Тогда в
насыщенном растворе Fe(OH)2 содержится 1 S моль/л ионов Fe 2+ и 2 Sмоль/л ионов OH — .
Выражение произведения растворимости гидроксида железа (II) можно записать как
ПР[Fe(OH)2] = [Fe 2+ ] . [OH — ] 2 = S . (2S) 2 = 4S 3 .
Теперь рассчитаем растворимость Fe(OH)3, обозначив её через S’ моль/л. Тогда в насыщенном растворе Fe(OH)3 содержится S’ моль/л ионов Fe 3+ и 3S’ моль/л ионов OH — .
Выражение произведения растворимости гидроксида железа (III) можно записать как
ПР[Fe(OH)3] = [Fe 3+ ] . [OH — ] 3 = S . (3S) 3 = 27S’ 4 .
Ответ: в 38497 раз.
Задача 568.
Образуется ли осадок сульфата серебра, если к 0,02 М раствору AgNO3 добавить равный объем 1 н. раствора H2SO4?
Решение:
ПР[Ag2SO4] = 2 . 10 -5 .
CM(H2SO4) = 1/2 CH(H2SO4) = 1/2 = 0,5 моль/л.
При смешении растворов AgNO3 и H2SO4 происходит реакция, при которой образуется малорастворимое соединение Ag2SO4. Реакция протекает по схеме:
При смешении растворов gNO3 и H2SO4 объём смеси увеличится в 2 раза, следовательно, концентрации всех веществ уменьшатся тоже в 2 раза и становятся равными:
Так как произведение концентраций ионов больше величины произведения растворимости, то осадок соли образуется.
Ответ: Да.
Задача 569.
К 50 мл 0,001 н. раствора НСI добавили 450 мл 0,0001 н. раствора AgNO3. Выпадет ли осадок хлорида серебра?
Решение:
Уравнение реакции имеет вид:
Находим количество HCl в 50 мл 0,001 н раствора из пропорции:
Теперь рассчитаем концентрацию HCl в 500 мл после разбавления водой раствора из пропорции:
Рассчитаем количество AgNO3, содержащееся в 450 мл 0,0001 н раствора его из пропорции:
Теперь рассчитаем концентрацию AgNO3 в 500 мл после разбавления водой раствора из пропорции:
Таким образом, концентрации ионов Ag + и Cl — в 1 л раствора, получим:
[Cl — ] = [HCl] = 1 . 10 -4 моль/л;
[Ag + ] = [AgNO3] = 9 . 10 -4 моль/л.
[Ag + ] . [Cl — ] = (1 . 10 -4 ) . (9 . 10 -4 ) = 9 . 10 -8
Осадок образуется так как [Ag + ] . [Cl — ] > ПР(AgClA); (9 . 10 -4 ) > (1 . 10- 4 ).
Ответ: Да.
Задача 570.
Образуется ли осадок хлорида свинца, если к 0,1 н. раствору Pb(NO3)2 добавить равный объем 0,4 н. раствора NaCl?
Решение:
ПР(PbCl2) = 2,12 . 10 -5 .
Уравнение реакции имеет вид:
Pb(NO3)2 + 2NaCl = PbCl2 + 2NaNO3.
При смешивании равных объёмов растворов Pb(NO3)2 и NaCl объём смеси увеличится в 2 раза, следовательно, концентрации веществ уменьшатся в 2 раза и становятся равными:
[Pb 2+ ] =1/2 1/2[Pb(NO3)2] = 0,2/2 = 0,1 моль/л;
[Cl — ] = 1/2[NaCl] = 0,4/2 = 0,2 моль/л.
[Pb 2+ ] . [Cl — ] 2 = 0,1 . (0,2) 2 = 4 . 10 -3 .
Осадок образуется так как [Pb 2+ ] . [Cl — ] 2 > ПР(PbCl2); = (4 . 10 -3 ) > (2,12 . 10 -5 ).
http://gomolog.ru/reshebniki/9-klass/tetrad-gabrielyan-2020/19/chast-1-zadanie-2.html
http://buzani.ru/zadachi/khimiya-glinka/1190-rastvorimost-solej-zadachi-567-570