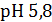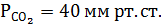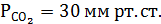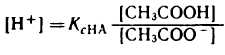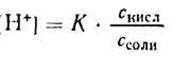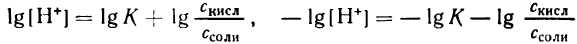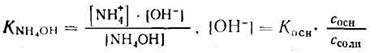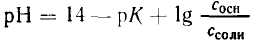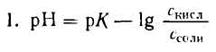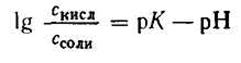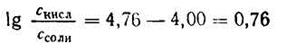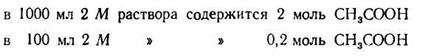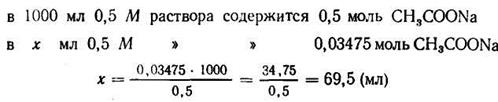Ситуационные и учебно-познавательные задачи.
Читайте также:
|
|
рНб – ?
Ответ: рНацетатного буфера=5,4
3. Какие объемы компонентов бикарбонатного буфера с одинаковой исходной концентрацией нужно взять, чтобы получить 100 мл буферного раствора с рН 6,0. 
|
Краткое изложение задачи: Решение:
V(
V(NaH 
Ответ: V( 
4. К 25 мл ацетатного буфера с рН 4,3 прибавили 5,0 мл 0,1э HCl, что привело к снижению рН до 3,7. Рассчитать буферную емкость по кислоте.
Краткое изложение задачи:


Ответ: Вк = 0,033 моль/л
5. 
Ответ:
Защита от кислоты:

Защита от щелочи:

Na
6. Какое нарушение КОР у больного, если рНкрови7,1 а 
Ответ: Сравним: в норме рНкрови7,4, а
Понижение рНкрови до 7,1 при нарушенном парциальном давлении свидетельствует о респираторном ацидозе. Причем, исходя из уравнения Гендерсона-Гассельбаха для бикарбонатного буфера (см. выше), мы видим четкую причинно-следсвенную связь: повышение парциального давления углекислого газа приводит к снижению рН. Дальнейшие действия врача – дифференцировать патологию органов дыхания и угнетение дыхательного центра.
7. Какое нарушение КОР у больного, если рНкрови7,1 а
Каковы причины такого нарушения?
Ответ: Сравним: в норме рНкрови7,4, а
Понижение рНкрови до 7,1 при нормальном парциальном давлении свидетельствует о метаболическом ацидозе. Причем, исходя из буферного уравнения Гендерсона-Гассельбаха (см. выше), можно предположить, что причиной ацидоза, по всей видимости является снижение щелочного резерва крови, в частности – бикарбонатов, гидрофосфатов. Дальнейшие действия врача – дифференцировать патологию органов пищеварения, кровообращения и почек.
8. Какое нарушение КОР можно предположить, если рНкрови7,4,
а
Ответ: Сравним: в норме рНкрови7,4, а
Отсутствие изменений рНкрови при пониженном парциальном давлении свидетельствует о компенсированном ацидозе. По-видимому, за счет увеличения вентиляции легких и, таким образом, снижения содержания кислых компонентов удается компенсировать недостаток бикарбонатов, дигидрофосфатов. Тем самым, соотношение основных и кислых компонентов крови поддерживается постоянным. Дальнейшие действия врача – выяснить причину снижения щелочного резерва организма (дифференцировать патологию органов пищеварения, кровообращения и почек).
Дата добавления: 2015-04-26 ; просмотров: 4 | Нарушение авторских прав
Вычисление рН буферных растворов Уравнение Гендерсона -Хассельбаха
1) Аналитическое выражение для расчета рН буферного раствора, например, ацетатного буфера можно получить из уравнения для константы диссоциации (к реакциям диссоциации применим закон действующих масс).
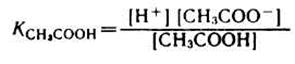
разрешив его относительно концентрации ионов водорода [H + ] можно написать:
Уксусная кислотаприсутствует в растворе в смеси с CH3COONa в виде неионизированных молекул. Поэтому концентрацию молекул можно принять равной общей молярной концентрации кислоты в растворе, т. е. [СН3СООН] = Скисл. Концентрацию анионов уксусной кислоты можно принять равной концентрации соли, т. е. [СН3СОО — ] = Ссоли, так как CH3COONa— сильный электролит, диссоциирующий в растворе на 100%. Приняв эти упрощения, получим:
2. Логарифмируя полученное уравнение и заменяя знаки логарифмов на обратные, получаем:
но – Ig [Н + ] есть рН, а – Ig К есть рК — силовой показатель кислоты.
С учетом этого получим:
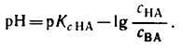
Если при приготовлении буферной системы взять одинаковые концентрации кислоты и соли, то концентрация ионов водорода в таком растворе будет равна константе ионизации кислоты, так как отношение Скис/Ссоли = 1 и [Н + ]=К1, т.е. [Н + ]=К, поэтому рН=рК.
Аналогично для систем NH4OH + NH4C1получают выражения:
1. Запишем уравнение константы ионизации NH4OH и найдем [ОН — ]:
2. Отсюда находим:
Зная, что рН + рОН = 14, получим:
Задача 1. Сколько 0,5 М раствора CH3COONa нужно прибавить к 100 мл 2М раствора СН3СООН, чтобы получить буферный раствор с рН=4?
Откуда
Подставляем числовые данные и получаем:
Число Ig 0,76 = 5,754. Следовательно, отношение концентрации кислоты к концентрации соли должно быть равно 5,754 : 1.
2. Находим концентрацию кислоты в буферной системе:
3. Зная концентрацию кислоты, находим концентрацию солив буферной системе; она должна быть равна 0,2:5,754= 0,03475 (моль).
4. Находим количество 0,5 М раствора ацетата натрия, содержащего 0,03475 моль:
Задача 2.Вычислить рН аммиачной буферной системы, содержащей по 0,5 М NH4ОН и NH4C1. Как изменится рН при добавлении к 1 л этой смеси 0,1 М НС1 и при добавлении к 1 л этой смеси 0,1 М NaOH и при разбавлении раствора водой в 10 раз, если рК (NH4ОН) =4,75?
Дата добавления: 2015-08-08 ; просмотров: 10312 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Практическое занятие №:8 «Протолитические равновесия и процессы. Буферные системы крови»
Практическое занятие №:8 «Протолитические равновесия и процессы. Буферные системы крови».
Общая цель: сформировать базовые знания о механизме действия буферных систем организма, их важной роли в поддержании кислотно-основного баланса как компонента гомеостаза, ценностное отношение к полученным знаниям для последующего медицинского образования.
Сделайте записи в лабораторной тетради по плану:
- Дата Номер занятия Тема занятия Основные вопросы темы — учебные вопросы занятия
Учебные вопросы занятия:
Буферное действие — основной механизм протолитического гомеостаза организма. Буферные растворы: определение, классификация по составу и действию. Механизм действия буферных систем. Характеристика буферных систем: Расчет pH буферных систем. Уравнение Гендерсона-Гессельбаха. Буферная емкость: определение и формула расчета. Зона буферного действия: определение, формула расчета. Буферные системы крови: гидрокарбонатная, фосфатная, гемоглобиновая, протеиновая, их состав, механизм действия, буферная емкость. Понятие о кислотно-основном состоянии организма.
6.1. Щелочной резерв крови: определение и количественная оценка.
6.2. Ацидоз, его виды.
6.3. Алкалоз, его виды.
Применение реакции нейтрализации в фармакотерапии: лекарственные средства с кислотными и основными свойствами (гидрокарбонат натрия, оксид и пероксид магния, трисамин и др.)
При отработке 1 вопроса следует ответить:
- что такое гомеостаз? одна из составляющих гомеостаза – это кислотно-основное равновесие, которое характеризуется постоянным значением pH крови = 7,4 объяснить, что такое буферное действие
При отработке 2 вопроса следует ответить:
- что такое буферные растворы? привести примеры буферных растворов в виде сопряженных кислотно
- указать какие буферные растворы поддерживают pHпостоянным в кислой и щелочной части шкалы pH.
При отработке 3 вопроса следует ответить:
- объяснить механизм действия буферных растворов при добавлении кислоты или щелочи, с помощью химических реакций объяснить почему не происходит смещения pH при разведении буферных растворов?
При отработке 4 вопроса следует ответить:
- написать уравнение Гендерсона-Гассельбаха, сделать его анализ: от чего зависит pH буферного раствора? дать определение буферной емкости, как количественно она оценивается, привести формулу по которой она рассчитывается. от каких факторов зависит буферная емкость? объяснить, что такое зона буферного действия, написать формулу, указать от чего зависит зона буферного действия.
При отработке 5 вопроса следует ответить:
- перечислить буферные системы крови. написать состав всех буферных систем крови в виде сопряженных кислотно-основных пар. на примере одной из буферных систем (по выбору) покажите механизм действия. укажите буферную емкость этих систем в плазме и эритроците.
При отработке 6 вопроса, следует ответить:
- что такое щелочной резерв крови? чем он обеспечивается? факторы, влияющие на изменение щелочного резерва крови, приводящие к смещению pH крови. охарактеризовать ацидоз и алкалоз, их виды. возможная коррекция кислотно-основного равновесия.
При отработке 7 вопроса, следует ответить:
- охарактеризовать химические свойства указанных соединений. привести реакции нейтрализации с указанными соединениями.
7.Вопросы и задания для самоконтроля
1.Буферные системы, их состав, свойства, классификация. Механизм буферного действия. Буферные растворы
2.Уравнение кислых буферных систем Гендерсона-Гассельбаха, его вывод и анализ. Зона буферного действия.
3.Буферная емкость. Факторы, влияющие на величину буферной емкости.
4.Биологическая роль буферных систем. Буферные системы крови: гемоглобиновая, оксигемоглобиновая, белковая, водородкарбонатная, фосфатная, эфиры глюкозы и фосфорной кислоты различной степени замещенности.
5.Роль водородкарбонатной буферной системы в поддержании постоянства рН крови. Ацидоз. Алкалоз. Щелочной резерв крови.
Задача 1. Рассчитайте рН ацетатного буферного раствора, приготовленного из 80 мл 0,1 М раствора СН3СООН и 20 мл 0,1 М раствора СН3СООNa. Ка (СН3СООН) = 1,74 · 10– 5.
С (СН3СООН) = 0,1 М
1. Находим рКкислоты:
рКкислоты = – lgКа = – lg 1,74 · 10– 5 = 4,76
Vр (СН3СООН) = 80 мл = 0,08 л
С (СН3СООNa) = 0,1 М
2. Находим рН ацетатного буферного раствора:
Vр (СН3СООNa) = 20 мл
КД (СН3СООН) = 1,74 · 10– 5
рН = рКа + lg ———— = 4,76 + lg ————— = 4,16
Задача 2. Рассчитайте буферную емкость по кислоте, если при добавлении к 100 мл гидрокарбонатного буфера с рН = 6,5 10 мл раствора НСl с молярной концентрацией эквивалента С(НСl) = 0,1 моль/л изменился до 6,3.
C(НСl) = 0,1 моль/дм3
Bа = V(HCI)·С(НСl) /Vбуф. ·ДpH
Bа = 10 · 0,1 / 100 · (6,5 – 6,3) = 0,05 моль/л
Ответ:Bк = 0,05 моль/л
Ситуационная задача 1.
При обследовании пациента обнаружено, что рН плазмы крови равен 7,2. К каким заболеваниям может привести это отклонение рН от нормы и как можно ликвидировать эту патологию?
а) Приводит ли это отклонение рН к ацидозу?
б) Приводит ли это отклонение рН к алкалозу?
в) Можно ли ликвидировать это отклонение рН при приеме пациентом 0,9%раствора NaCl?
г) Можно ли ликвидировать это отклонение рН при приеме пациентом раствора NaHCO3?
д) Можно ли ликвидировать это отклонение рН при приеме пациентом раствора NH4Cl?
Снижение рН плазмы крови по сравнению с нормой (7,40) приводит к ацидозу.
Ликвидировать это снижение рН можно приемом пациентом NaHCO3,так как эта соль дает при гидролизе щелочную реакцию среды.
Нельзя применять 0,9% раствор NaCl, имеющий нейтральную реакцию и растворNH4Cl, дающий при гидролизе кислую реакцию среды.
Ситуационная задача 2.
При нахождении дома у человека возникла изжога, связанная с повышенной кислотностью. В его распоряжении имелись следующие препараты: оксид магния MgO, хлорид аммонияNH4Cl, питьевая содаNaНCO3 ,хлорид кальцияCaCl2 и глауберова сольNa2SO410H⋅2O. Какой из препаратов предпочтительнее использовать для ликвидации изжоги?
а) Оксид магния MgO.
б) Хлорид аммония NH4Cl.
в) Питьевая сода NaНCO3.
г) Хлорид кальция CaCl2.
д) Глауберова соль Na2SO410H⋅2O.
Для ликвидации изжоги можно использовать MgOиNaНCO3,так как они нейтрализуют повышенную кислотность желудочного сока:
2HCl + 2NaHCO3= 2NaCl + CO2+ H↑2O
2HCl + MgO = MgCl2+ H2O
Однако, оксид магния имеет преимущество перед NaHCO3,так как при взаимодействии MgOс кислотой не выделяетсяCO2,то есть не наблюдается гиперсекреция. NH4Cl, Na2SO4 ·10H2O и CaCl2 нельзя использовать, так как водные растворы этих солей имеют соответственно кислую и нейтральную реакцию среды и не могут нейтрализовать избытокHClв организме.
Тестовые задания для самоконтроля
Выберите правильный вариант ответа
Буферными свойствами обладают сопряженные кислотно — основные пары: а) HCOO-/HCOOH; б)CH3COO-/CH3COOH;
в) Cl-/HCl; г)HCO-3/CO2; д)HPO42-/H2PO-4;
1)все; 2)а, б,г, д; 3)б, г,д; 4)б, г.
При добавлении HCl в буферной системе NH+4/NH3 ∙H2O:
1)активная концентрация NH+4 уменьшается, NH3 ∙ H2O – увеличивается.
2) активная концентрация NH+4 увеличивается, NH3 ∙H2O — уменьшается.
3)активность компонентов не изменяются.
Фосфатная буферная система содержит в организме кислотно-основные сопряженные пары:
1) H3PO4 – кислота, H2PO4- — сопряженное основание;
2) H2PO4- – кислота, HPO2-4 — сопряженное основание;
3) HPO2-4 – кислота, PO3-4 — сопряженное основание;
4) H3PO4 – кислота, PO3-4 — сопряженное основание;
При физиологическом значении pH соотношение концентраций компонентов в гидрокарбонатной буферной системе крови [HCO3-]/[CO2] =18:1. Следовательно, буферная емкость этой системы по кислоте в сравнении с буферной емкостью по основанию:
1)больше; 2)меньше; 3)их значения равны.
Увеличение щелочных продуктов метаболизма концентрацию CO2 в плазме крови:
1)увеличивает; 2)уменьшает; 3)не изменяет.
Концентрации ионов водорода в плазме крови можно рассчитать по уравнению
2) pH = pKa + lgсопр. основ/кислота;
3) pH = pKa + lg HCO3- / p ∙ S CO2
Респираторный ацидоз связан
1) с гипервентиляцией легких;
2) с гиповентиляциейлегких;
3) с возбуждением дыхательного центра;
4) с повышением конентрацииHCO3-.
Приготовить буферный раствор с pH = 7,4 можно на основании системы:
Роль кислот в составе буферных систем могут выполнять частицы
4) CH3COOH, Al(OH)2+.
Самые мощные буферные системы в составе эритроцитов:
1) ацетатная и белковая;
2) гемоглобиновая и аммиачная;
3) гидрокарбонатная и гемоглобиновая;
4) фосфатная и ацетатная.
11. Способность буферных систем сохранять постоянство водородного показателя среды называется ___________________.
12. Водородный показатель среды буферного раствора зависит от природы компонентов буфера, температуры и величины____________.
http://helpiks.org/4-60678.html
http://pandia.ru/text/82/157/82587.php
 отсюда
отсюда  и
и 

 = 4,8 +
= 4,8 + 




 V(NaH
V(NaH