Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
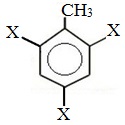
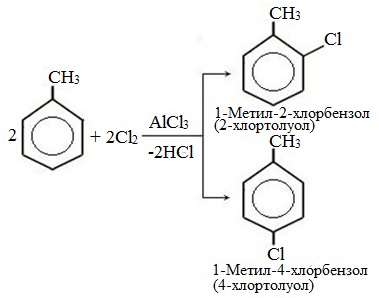
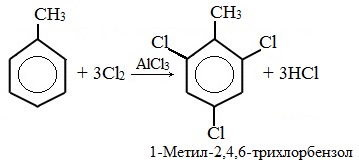
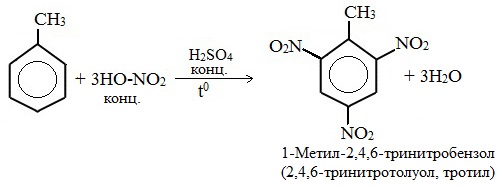
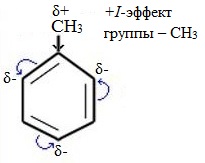
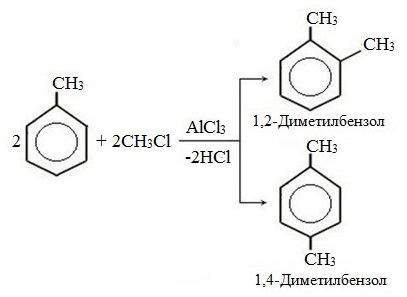
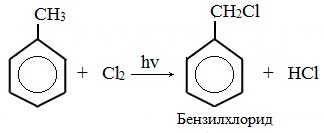
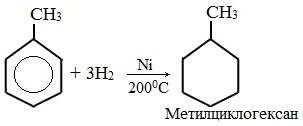
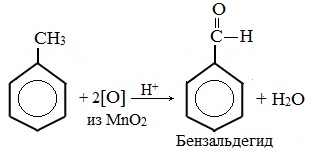
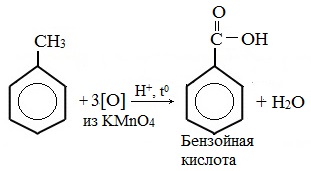
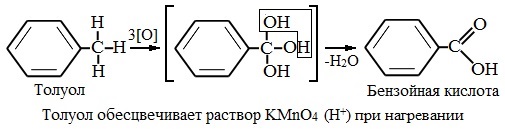
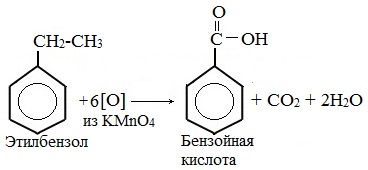
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Задание составьте уравнения осуществимых реакций толуол kmno4Все реакции толуола (метилбензола) можно подразделить на два типа: реакции, затрагивающие бензольное кольцо и реакции, затрагивающие метильную группу. Реакции замещения1. Реакции с участием бензольного кольца Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большой скоростью. Метильный радикал, содержащийся в молекуле толуола, является ориентантом I рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара- производные толуола или при избытке реагента – трипроизводные общей формулы: а) галогениерование При избытке галогена можно получить ди- и три-замешенные производные в соответствии с правилами ориентации: б) нитрование Например, при нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водорода с образованием 2,4,6-тринитротолуола: Здесь ярко проявляется взаимное влияние атомов в молекуле на реакционную способность вещества. С одной стороны, метильная группа СH3 (за счет +I-эффекта) повышает электронную плотность в бензольном кольце в положениях 2, 4 и 6 и облегчает замещение именно в этих положениях: С другой стороны, под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения по сравнению с метаном СH4. в) сульфирование г) алкилирование 2. Реакции с участием боковой цепи Метильная группа в метилбензоле может вступать в реакции, характерные для алканов: Это объясняется тем, что на лимитирующей стадии легко (при невысокой энергии активации) образуется радикал бензил ·CH2-C6H5. Он более стабилен, чем алкильные свободные радикалы (·СН3, ·СH2R), т.к. его неспаренный электрон делокализован за счет взаимодействия с π- электронной системой бензольного кольца: Реакции присоединенияа) гидрирование Реакции окисленияа) горение б) неполное окисление В отличие от бензола его гомологи подвергаются окислению легче предельных углеводородов. При этом окислению подвергаются лишь радикалы, связанные с бензольным кольцом, в случае толуола — метильная группа. Мягкие окислите (MnО2) окисляют ее до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты: Толуол, в отличие от метана, окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании). Любой гомолог бензола с одной боковой цепью окисляется KMnO4 и другим сильным окислителем в бензойную кислоту: Гомологи, содержащие две боковые цепи, дают двухосновные кислоты: Замечания, решения и ответы второму заданиюЗамечания, решения и ответы второму заданию I. Замечания технического характера Не забывайте указывать свою фамилию на листах документа с ответами. Называйте файл с ответами своей фамилией. II. Анализ решений и ответы Задание 1. Определите усредненную степень окисления атомов углерода алгебраическим методом и степень окисления каждого атома углерода графическим методом в следующих соединениях: 2-аминопропан, глицерин, 1,2 – дихлорпропан, аланин, метилфенилкетон. Допущенные ошибки: 1) неправильно составлена структурная или молекулярная формулы вещества; 2) допущены арифметические ошибки в расчете усредненной степени окисления; 3) некоторые участники мастер-класса нашли либо усредненную степень окисления алгебраически, либо индивидуальную степень окисления графическим способом, то есть выполнили задание частично. В этом задании можно было проверить правильность вычисления усредненной степени окисления так: сложить все индивидуальные степени окисления атомов углерода и разделить сумму на число атомов углерода. Правильное выполнение этого задания привожу из работы Натальи Валерьевны Ушаковой: Задание 2. Составьте уравнения реакций: 1) горения стеариновой кислоты в кислороде; 2) полного окисления глюкозы концентрированной азотной кислотой. Используя усредненную степень окисления углерода, составьте электронный баланс и расставьте коэффициенты Допущенные ошибки: 1) неправильно составлена формула органического вещества; 2) допущены арифметические ошибки в расчете усредненной степени окисления углерода; 3) допущены ошибки в вычислении числа отданных углеродом электронов; 4) неправильно определены продукты реакции. Это связано, по всей видимости, с невнимательным прочтением пояснений и задания. Полное окисление идет до образования углекислого газа. В некоторых работах в качестве продукта восстановления концентрированной азотной кислоты указан оксид азота (II) и даже азот; 5) в некоторых работах в балансе не учтен индекс при углероде; 6) некоторые участники мастер-класса использовали не усредненную степень окисления в стеариновой кислоте, а индивидуальные степени окисления, что не соответствует заданию. Правильное решение (из работы ): 1) Составьте уравнение реакции окисления этанола подкисленным раствором перманганата калия при нагревании с образованием уксусного альдегида. 2) Составьте уравнение реакции окисления толуола подкисленным раствором перманганата калия при нагревании с образованием бензойной кислоты. В электронном балансе используйте степени окисления только тех атомов углерода, которые меняют степень окисления. Допущенные ошибки: 1) в некоторых работах неправильно составлены формулы исходных веществ и продуктов; 2) в балансе используются степени окисления атомов, которые не участвовали в реакции; 3)найденные в балансе коэффициенты не перенесены в уравнение или перенесены неправильно. Правильное решение (из работы ): 1) Составьте уравнение реакции деструктивного окисления по обеим двойным связям 4-метилпентадиена – 1,3 подкисленным раствором перманганата калия при нагревании. Ошибки: Во многих работах неправильно определен один из продуктов – вместо щавелевой кислоты – уксусная. Встречались ошибки и в составлении формулы исходного вещества. Некоторые участники мастер-класса не обратили внимание на то, что окисление деструктивное и пытались сохранить углеродную цепь в продуктах. 2) Составьте уравнение реакции окисления стирола водным раствором перманганата калия при нагревании. Ошибки: многие решили, что получится двухатомный спирт. Это неверно, так как реакция Вагнера идет без нагревания, а в условиях нашего задания нагревание указано. Многие забыли, что в нейтральной среде получаются не кислоты, а соли, углекислый газ превращается в гидрокарбонат или карбонат. Некоторые не учли, что гидрокарбонат и щелочь в продуктах одновременно существовать не могут, происходит нейтрализация гидрокарбоната. 3) Составьте уравнение реакции окисления 1-изопропил-3-метил-2-пропил-5-этилбензола щелочным раствором перманганата калия при нагревании. Ошибки: В некоторых работах среди продуктов обнаружился углекислый газ и карбоновые кислоты, хотя в щелочной среде однозначно получаются соли карбоновых кислот, углекислый газ превращается в карбонат. Некоторые в качестве продукта указали формиат (в приведенных условиях он окисляется до карбоната). Были работы, в которых оказались неучтенными некоторые атомы углерода, изменившие степень окисления, допущены арифметические ошибки – неправильно определена сумма отданных углеродом электронов. Решение 1 пункта задания 4 взято из работы Татьяны Леонидовны Быковой:
2С-1 – 8е ® 2С+3 16е 5 восстановитель Mn+7 + 5е ® Mn+2 16 окислитель С0 + 2С-1+ С-2 – 16е ® С+2 + 2С+3 + С+4 Решения 2 и 3 пункта задания 4 взяты из работы Нелли Ивановны Ариновой: 2) С6Н5 – С-1Н=С-2Н2 +KMn+7O4+H2O® С6Н5 – С+3ООK + Mn+4O2 + KOH+KHС+4 O3
С -2 – 6е ® С+4 — 10 е 3 восстановитель Mn+7 + 3е ® Mn+4 10 окислитель Ставим коэффициенты перед углеродом и марганцем, уравниваем калий: 3С6Н5 – СН=СН2 +10KMnO4+H2O® 3С6Н5 – СООK + 10MnO2 + 4KOH+3KHСO3 Учитывая то, что кислая соль нейтрализуется щелочью: 4KOH+ 3КНСО3 ® 3К2СО3 + КOH + 3H2O изменим продукты реакции: 3С6Н5 – СН=СН2 +10KMnO4+H2O® 3С6Н5 – СООK + 10MnO2 + 3К2СО3+ KOH Проверим число атомов водорода в правой части уравнения – 16, в левой части – 24 без учета воды, следовательно, воду нужно перенести в правую часть: 3С6Н5 – СН=СН2 +10KMnO4 ® 3С6Н5 – СООK + 10MnO2 + 3К2СО3+ KOH + 4H2O
3С-3 – 21е ®3С+4 46 1 восстановитель Mn+7 + 1е ® Mn+6 46 окислитель С15Н30 +46KMnO4 + 57KOH® С10Н8О8К4 + 3К2СО3 + СН3–СООK+ 46K2MnO4 +38H2O источники: http://himija-online.ru/organicheskaya-ximiya/areny/ximicheskie-svojstva-toluola.html http://pandia.ru/text/80/137/52063.php |




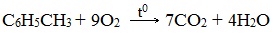
















 ® 5СН3-С=О + 5НООС—СООН + 5СО2 + 16MnSО4 + 8К2SО4 + 29Н2О
® 5СН3-С=О + 5НООС—СООН + 5СО2 + 16MnSО4 + 8К2SО4 + 29Н2О
 С0 — 2е ® С+2
С0 — 2е ® С+2
 С-1 – 4е ® С+3
С-1 – 4е ® С+3 3) С-3Н3
3) С-3Н3


 НС-1 С0 – С-1Н – С-3Н3
НС-1 С0 – С-1Н – С-3Н3
 С-3Н3 – С-2Н2 – С0 С0 – С-2Н2 – С-2Н2 – С-3Н3 + KMn+7O4 + KOH®
С-3Н3 – С-2Н2 – С0 С0 – С-2Н2 – С-2Н2 – С-3Н3 + KMn+7O4 + KOH® НС-1 С0 – С-3Н3
НС-1 С0 – С-3Н3


 НС-1 С0 – С+3ООК
НС-1 С0 – С+3ООК
 КООС+3–С0 С0–С +3ООК+К2С+4О3 +С-3Н3–С+3ООK+K2Mn+6O4 +H2O
КООС+3–С0 С0–С +3ООК+К2С+4О3 +С-3Н3–С+3ООK+K2Mn+6O4 +H2O
 С-1 – 4е ® С+3
С-1 – 4е ® С+3