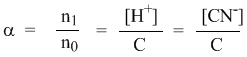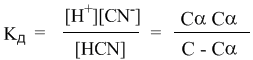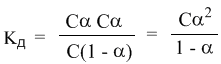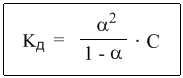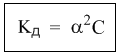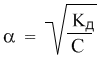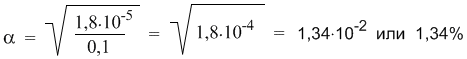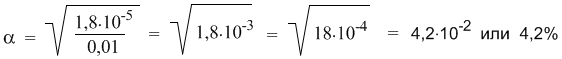Закон разведения оствальда выражается уравнением
§10.2.** Зависимость степени диссоциации от концентрации. Закон разбавления Оствальда.
В предыдущем параграфе мы качественно, на основе принципа Ле Шателье установили, что разбавление раствора должно приводить к увеличению степени диссоциации α. Но эту взаимосвязь можно выразить и количественно.
Рассмотрим электролит, молекулы которого XY распадаются в растворе на два иона – катион и анион. Фактически, степень диссоциации α представляет собой долю распавшихся молекул. Если общую концентрацию электролита (С) умножить на эту долю, то получим концентрацию любого из ионов. Иными словами, αС = [X + ] моль/л, и αC = [Y – ] моль/л.
Если электролит сильный (α = 1), концентрация каждого из ионов просто равна исходной концентрации электролита. Например, в 1 литре 0,1 М раствора NaCl содержится 0,1 моль ионов Na + и 0,1 моль ионов Cl – .
К физическому смыслу произведения αС можно прийти и другим путем. Допустим, имеется раствор циановодорода HCN (синильной кислоты) с концентрацией С моль/л. В растворе циановодород слабо диссоциирует на ионы:
HCN 
Напомним, что в выражении для степени диссоциации α величина n0 отражает количество молекул (или молей) HCN, изначально попавших в раствор. Иными словами, n0 = C моль/л. Напомним также, что n1 – это число молекул (или молей) HCN, распавшихся на ионы. Следовательно, n1 = [H + ] и n1 = [CN – ]. В этом случае:
Отсюда следует, что
[H + ] = Cα,
[CN – ] = Cα.
Итак, мы приходим к тому же выводу: чтобы получить концентрацию любого из ионов в растворе, достаточно общую концентрацию вещества С умножить на коэффициент α – степень его диссоциации.
Если теперь записать выражение для константы диссоциации HCN, то можно выразить Кд через Сα:
Концентрация недиссоциированных молекул [HCN] в равновесии должна быть меньше исходной концентрации С как раз на величину Сα – отсюда выражение (С – Сα) в знаменателе дроби. Если вынести концентрацию С за скобки и сократить, то получим следующее выражение:
Или, в другой записи:
Это не что иное, как математическая формулировка закона разбавления Оствальда. Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности.
Однако в случае слабых электролитов величина (1 – α) очень мало отличается от единицы. Действительно, если α = 0,01, то (1 – 0,01) = 0,99, т.е. практически 1. Таким образом, для слабых электролитов закон разбавления Оствальда можно записать в более простом виде:

Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10 –5 . Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α 2 С. Отсюда:
Подставляя в эту формулу численные значения, получим:
Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда:
Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла.
Рекомендуем решить приведенные ниже задачи на разбавление растворов – они тоже дают представление о сфере применимости только что рассмотренного закона.
10.5. **(ФМШ). Сколько воды надо прибавить к 300 миллилитрам 0,2 М раствора уксусной кислоты СН3СООН (Кд = 1,8·10 –5 ), чтобы степень диссоциации кислоты удвоилась?
10.6. **(ФМШ). Сколько воды надо прибавить к 200 мл 0,27 М раствора муравьиной кислоты НСООН (Кд = 1,8·10 –4 ), чтобы степень диссоциации увеличилась в 3 раза?
Подсказка к задаче 10.5. Эта задача проще, чем может показаться на первый взгляд. Численное значение константы диссоциации кислоты при решении вам не потребуется. В задаче оно приведено для того, чтобы было понятно, что кислота слабая и к ее растворам применим закон разбавления Оствальда в виде: Кд = α 2 С. По условию задачи степени диссоциации после разбавления и до разбавления соотносятся как α2 = 2α1. Если выразить обе α через закон разбавления, то при дальнейшем решении значения Кд сокращаются. Есть способ решения, в котором значение концентрации раствора 0,2 М тоже не обязательно использовать (напомним, что большая буква «М» означает «моль/л»). Попробуйте найти это решение.
Закон разведения оствальда выражается уравнением
Глава 3. Электролитическая диссоциация
§ 17. Закон разбавления Оствальда
Степень диссоциации определяется константой диссоциации и концентрацией слабого электролита в растворе.
Рассмотрим равновесные молярные концентрации исходного слабого электролита и образовавшихся катионов и анионов в состоянии химического равновесия:
| Молярные концентрации веществ | MA | M + | A − |
| В начальный момент времени (τ0) | с0 | 0 | 0 |
| К моменту достижения равновесия (τравн.) | [MA] = (1−α )с0 | [M + ] = αс0 | [A − ] = αс0 |
Данное выражение было впервые выведено немецким физикохимиком В. Оствальдом (закон разбавления Оствальда). Закон разбавления показывает, что степень диссоциации данного слабого электролита зависит от его концентрации и константы диссоциации.
Последняя в данном растворителе и для данного электролита зависит только от температуры.
При очень низкой степени диссоциации (α 2 с0. В таком приближенном виде уравнение Оствальда чаще всего и используется химиками.
Рассматривая зависимость степени диссоциации от концентрации слабого электролита (рис. 6), мы обнаруживаем, что повышение концентрации ведет к снижению степени диссоциации, а разбавление раствора, наоборот, к ее повышению.
Рис. 6. Зависимость степени диссоциации α от концентрации слабого электролита в растворе с0.
При бесконечном разбавлении (когда концентрация электролита стремится к 0) степень диссоциации стремится к 1.
Экспериментальное обнаружение присутствия ионов в растворах электролитов
Как уже говорилось в гл. 3, кристаллографические исследования с помощью рентгеновских лучей свидетельствуют о существовании ионов в ионных кристаллах. Но откуда известно о существовании ионов в водных растворах электролитов? Эти сведения получены из целого ряда независимых источников.
Коллигативные свойства. Коллигативные свойства, например понижение температуры замерзания растворов, зависят от числа частиц, имеющихся в растворе, но не от их химической природы (см. гл. 6), и это позволяет убедиться в том, что при растворении электролита в раствор переходят не его молекулы, а диссоциированные ионы, число которых превышает число молекул.
Электропроводность. Прохождение электрического тока через электролит может быть объяснено, как указано выше, перемещением ионов, несущих электрические заряды. Сильные электролиты являются лучшими проводниками электрического тока, чем слабые электролиты. Более подробное обсуждение электропроводности содержится в гл. 10.
Электролиз. При пропускании электрического тока через электролит происходит химическое разложение электролита, так называемый электролиз. Это явление служит еще одним доказательством существования ионов в растворах электролитов. Подробное обсуждение электролиза тоже содержится в гл. 10.
Закон разбавления Оствальда
В 1888 г. Ф. Оствальд применил к рассмотрению диссоциации электролитов закон действующих масс (см. гл. 7). Таким образом он вывел соотношение между константой равновесия и степенью диссоциации электролита. Это соотношение получило название закона разбавления Оствальда. Вывод закона Оствальда основан на рассмотрении диссоциации слабого электролита. Допустим, что при растворении электролита BA в воде образуется раствор, имеющий концентрацию с. В результате некоторая часть а электролита BA диссоциирует, образуя ионы B+ и А-. Величина а называется степенью диссоциации. Равновесная концентрация неионизированного электролита BA оказывается равной с (I — а). Таким образом, можно записать
Запишем теперь выражение для константы равновесия рассматриваемой диссоциации
Подставив в это выражение равновесные концентрации участников диссоциации, получим
Это соотношение и представляет собой закон разбавления Оствальда. Константа Кс называется константой диссоциации электролита. Чем больше Кс, тем сильнее электролит.
Фридрих Вильгельм Оствальд, лауреат Нобелевской премии по химии 1909 г.
Фридрих Вильгельм Оствальд
Немецкий ученый Ф. В. Оствальд (1853-1932) был одним из основателей физической химии. Он известен не только тем, что открыл закон разбавления, но также и тем, что вскрыл механизм действия индикаторов. Оствальд показал, что индикаторы представляют собой слабые кислоты либо слабые основания, которые имеют неодинаковую окраску в недиссоциированном и диссоциированном состояниях (см. ниже). В 1909 г. Оствальд получил Нобелевскую премию по химии за свои работы но изучению катализа. Он первым предположил, что ката.is;j ускоряет химические реакции, понижая их энергию активации (см. гл. 9). Оствальд первым разработал технологический процесс окисления аммиака с помощью платинового катализатора. Этот процесс, носящий имя Оствальда, является одной из стадий промышленного производства азотной кислоты (см. гл. 15). Небезынтересно отмстить, что хотя Оствальд находился на переднем крае исследований в нескольких областях химии, он был одним из последних, кто сопротивлялся быстро развивавшейся атомистике-теории, впервые сформулированной Дальтоном еще в 1808 г. Лишь в 1906 г. Оствальд окончательно согласился с существованием атомов.
http://www.alhimik.ru/rastvory/3-17.html
http://www.himikatus.ru/art/ch-act/0370.php