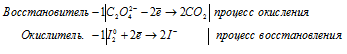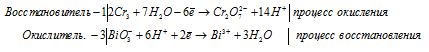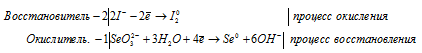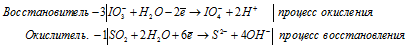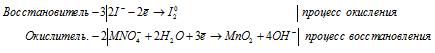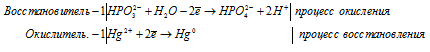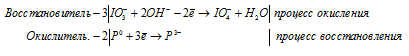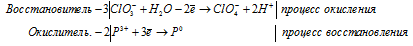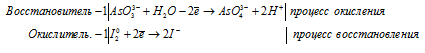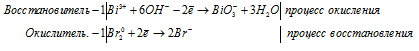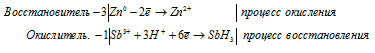Оксид натрия: способы получения и химические свойства
Оксид натрия Na2O — бинарное неорганическое вещество . Белое вещество, термически устойчивое, тугоплавкое.
Относительная молекулярная масса Mr = 61,98; относительная плотность для тв. и ж. состояния d = 2,36; tпл = 1132º C при избыточном давлении
Способ получения
1. Оксид натрия можно получить путем взаимодействия натрия и гидроксида натрия при 600º С, в результате образуется оксид натрия и водород :
2Na + 2NaOH = 2Na2O + H2
2. Оксид натрия получается при разложении пероксида натрия при температуре 400–675º C и вакууме. В результате разложения образуется оксид натрия и кислород:
3. Путем реакции между пероксидом натрия и натрием при 130–200º C в атмосфере аргона :
Химические свойства
1. Оксид натрия может взаимодействовать с простыми веществами :
1.1. Оксид натрия взаимодействует с кислородом при 250–350º C и повышенном давлении с образованием пероксида натрия :
2. Оксид натрия взаимодействует со сложными веществами:
2.1. Оксид натрия реагирует с водой . Образуется гидроксид натрия:
Na2O + H2O = 2NaOH
2.2. Оксид натрия взаимодействует с кислотами . При этом образуются соль и вода.
Например , оксид натрия с соляной кислотой образует хлорид натрия и воду:
Na2O + 2HCl = 2NaCl + H2O.
2.3. При взаимодействии натрия с оксидами образуются соли.
2.3.1. Реагируя с углекислым газом при 450–550º C оксид натрия образует карбонат натрия:
2.3.2. При 250º C, в результате взаимодействия оксида натрия, и оксидов азота образуется нитрат натрия:
2.3.3. Оксид натрия взаимодействует с оксидом алюминия при 1200º С. При это образуется алюминат натрия:
Составление уравнений реакций окислительно-восстановительных процессов
Задача 637.
Закончить уравнения реакций, записать их в молекулярной форме:
а) С2O4 2- + I2 → CO2 +
б) BiO3 — + Cr 3+ + H + → Cr2O7 2- +
в) SeO3 2- + I — + H2O → Se +
г) IO3 — + SO2 + H2O →
Решение:
а) С2O4 2- + I2 → CO2 +
Молекулярная форма процесса
б) BiO3 — + Cr 3+ + H + → Cr2O7 2- +
После приведения членов в обеих частях равенства получим:
Молекулярная форма процесса:
в) SeO3 2- + I — + H2O → Se +
Молекулярная форма процесса:
Молекулярная форма процесса:
Задача 638.
Закончить уравнения реакций, записать их в молекулярной форме:
а) MnO4 — + I — + H2O →
б) HPO3 2- + Hg 2+ + H2O → Hg +
в) P + IO3 — + OH — →
г) PCl3 + ClO3 — + H2O →
д) AsO3 — + I2 + H2O → AsO4 — +
е) Bi 3+ Br2 + OH — → BiO3 — +
ж) Sb3+ + Zn + H + → SbH3 +
Решение:
а) MnO4 — + I — + H2O →
Молекулярная форма процесса:
б) HPO3 2- + Hg 2+ + H2O → Hg +
Молекулярная форма процесса:
в) P + IO3 — + OH — →
Молекулярная форма процесса:
3ClO3 — + 2P 3+ + 3H2O → 3ClO4 — + 2P 0 + 6H +
Молекулярная форма процесса:
Молекулярная форма процесса:
е) Bi 3+ Br2 + OH — → BiO3 — +
Ионно-молекулярная форма процесса:
Молекулярная форма процесса:
ж) Sb3+ + Zn + H + → SbH3 +
Уравнения полуреакций:
Sb 3+ + 3Zn 0 + 3H + → SbH3 + 3Zn 2+
Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 13264770
Онтонио Веселко
1) Закончить уравнение химических реакций, указать тип
химич. реакции:
7) Fe H2SO4 →,
8) CaCO3 →.
9) Zn CuSO4=ZnSO4 Cu
10)BaCl2 K2CO3=BaCO3 KCl,
11) CaO CO2 CaCO3,
12) Fe(OH) 2=FeO H2O.
13) CO2 H2О=H2CO3,
16) H 2O Na= NaOH H2
2) Какой из указанных металлов проявляет наибольшую
химическую активность в реакции с соляной кислотой: 1) свинец, 2) магний, 3) цинк, 4)
медь.
3) Расставить
коэффициенты в уравнении:
Al H2SO4 = Al2(SO4)3 H2O
4 )Закончите уравнение и определите сумму всех
коэффициентов: Na H2O=…
а) 4, б) 5,
в) 6, г) 7
5) Выберите правую часть уравнения для реакции K H2O:
6) Установите соответствие между левой и правой
частями уравнения:
1. 2Na O2=
А. MgCO 3 H2
2. K2O H2O=
Б. 2Na 2O
3. Cu(OH)2 H2SO4=
В. Na 2O2
4. Mg H2CO3=
Г. 2KOH
Д. CuSO4 2H2O
?) Составьте, по желанию, синквейн либо кластер на тему типы химических реакций
Тест «Типы химических реакций»
Лучший ответ:
Главный Попко
Al2O3 6HCl=2AlCL3 3H2O обмен
Na2O H2O=2NaOH соединение
Fe H2SO4=FeSO4 H2 замещение
CaCO3=CaO CO2 разложение
Al2O3 6HCl=2AlCl3 3H2O обмен
NA2O H2O=2NaOH соединение
Fe H2SO4=FeSO4 H2 замещение
CaCO3=CaO CO2 разложение
Zn CuSO4=ZnSO4 Cu замещение
BaCL2 K2CO3=2KCl BaCO3 обмен
CaO CO2=CaCO3 соединение
Fe(OH)2=FeO H2O разложение
CO2 H2O=H2CO3 соединение
C 2H2=CH4 соединение
2H2O=2H2 O2 разложение
2NA 2H2O=2NaOH H2 замещение
http://buzani.ru/zadachi/khimiya-glinka/1219-zakanchivanie-uravnenij-reaktsij-zadacha-637
http://shkolenet.ru/QA/13264770/