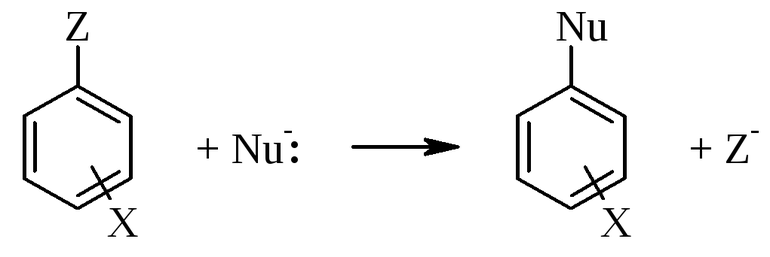Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2114b1ff819781 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Реакция замещения в химии — как определить, признаки, примеры уравнений
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
- Соединения. Условно записывают как А + Б = АБ или АБ + ВГ = АБВГ. Под таким типом понимают взаимодействие, при которой из ряда простых или сложных реагентов образуется одно.
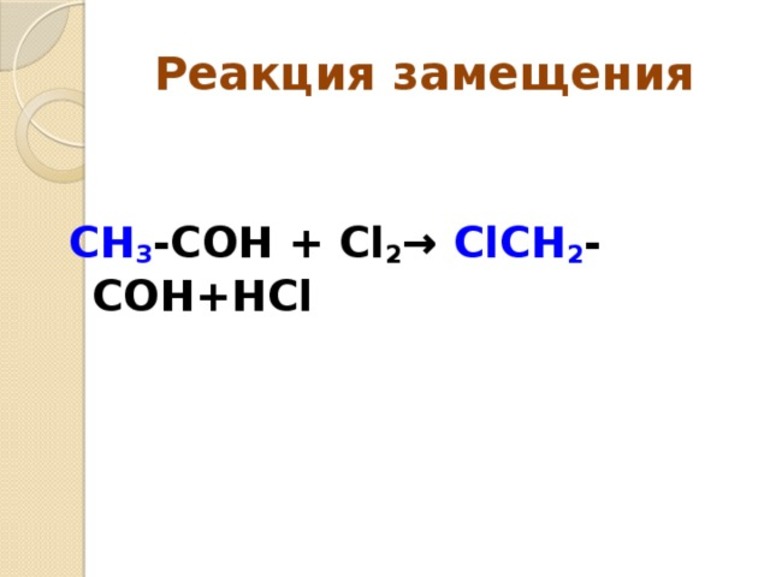
- Замещения. В этой реакции происходит взаимодействие двух веществ — простого и сложного. В результате части первого вещества вытесняют один из элементов сложного. Условно этот тип записывается как А + БВ — АВ + Б.
- Обмена. Это взаимодействие, происходящее между двумя сложными реагентами, которые отдают друг другу свои составные части. В итоге появляются два новых элемента. Схема записи такой реакции выглядит как АБ + ВГ — АГ + ВБ.
- Разложения. Реакция, при которой из одного исходного элемента образуется несколько менее сложных или простых веществ. Химическая схема взаимодействия выглядит как АБВГ — АБ + ВГ или АБ — А + Б.
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
- свободнорадикальная ®;
- нуклеофильная (N);
- электрофильная (E).
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
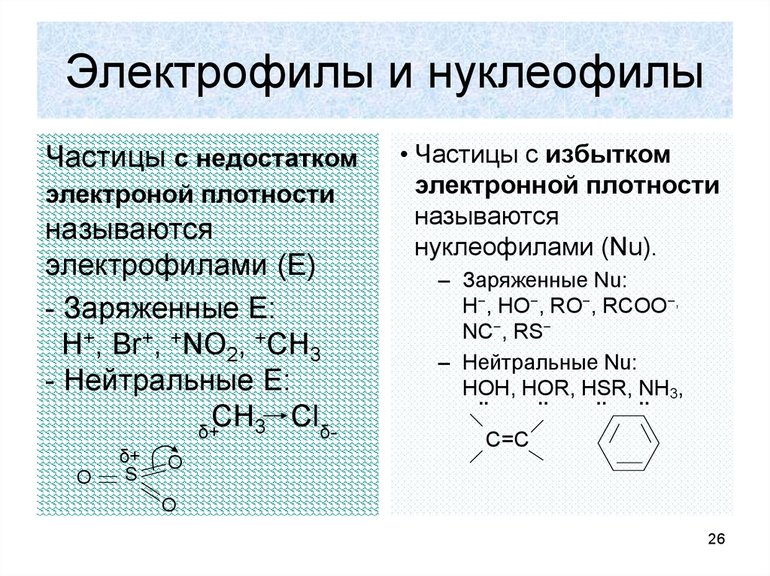
Образование новой связи происходит путём обобщения освободившейся свободной пары углерода с реагентом. При этом последний должен иметь положительный заряд или секстет электронов. Элемент в этом случае является электрофильной химической частичкой. Например, к таким реакциям замещения относится взаимодействие брома с углеродом. Формула такой записи, следующая: H3C: Br+: Br- — H3CBr + Br. Электрофильные реагенты бывают:
- нейтральными молекулами с нейтральной орбиталью (AlCl3, FeBr3, SnCl4);
- катионами (SO3H+, NO2+, NO+);
- молекулами с пониженной плотностью электронов (Cl2, Br2, I2).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
При нуклеофильной реакции происходит обобщение электронной пары, которую представляет реагент. Субстрат обладает дефицитом электронов (+), а реагент (-). Например, H3C+ + K+OH- — H3COH + K+. Есть закономерность, что все гетерополярные реакции проходят легче с полярными соединениями и поляризующимися связями.
Радикальные реакции
Радикалами называют отдельные атомы или их группы с неспаренным электроном. Алкильные обозначаются латинской буквой R с рядом стоящей точкой. Свободный электрон находится на p -орбитали, находящийся на перпендикулярной плоскости С. На геометрию радикала сильное влияние оказывают заместители. Существуют такие атомы короткое время и их количество незначительно.
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
- госмолитический разрыв ковалентной связи;
- перенос с иона или на него электрона.
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
- Инициирование цепи путём гомолитического разрыва Cl: Cl — Cl* + Cl* под действием фотолиза.
- Радикалы хлора пытаются стабилизироваться и начинают воздействовать на молекулы метана: Cl* + CH — HCl + *CH3. Хлор оттягивает на себя водород, а метан переходит в состояние метил радикала. На этой стадии происходит шквальное увеличение количества радикалов (рост цепи).
- Чтобы стабилизироваться, радикалы воздействуют на молекулы хлора, и образуется хлорметан с радикалом хлора CH3* + Cl2 — CH3Cl + Cl*.
- На конечной стадии происходит разрыв цепи, то есть радикалы встречаются и замыкаются друг на друге: 2Cl* — Cl или Cl* + CH — CH3Cl.
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
- Алканы. Соединения, состоящие из простых связей, насыщенных углеводородом: CnH2n + 2. Из-за большого количества органических соединений, состоящих из водорода и углерода реакция разложения для них неосуществима.
- Галогены. Они все являются окислителями. К ним относятся неметаллы. Наиболее яркие представители: хлор, йод, фтор, бром, астат. В процессе галогенирования водород, присутствующий в соединении, заменяется галогеном. Начиная с пропана С3Н8, алканы при радикальном замещении образуют изомеры. При термическом галогенировании процесс определяется числом C — H — связей и зависит от скорости, с которой галогены заменят водород.
- Алкены. Выделяются они присутствием в молекулах одной двойной связи. Именно она отвечает за их химические свойства. Реакция замещения свойственна элементам с двойными и тройными связями. К ней относят гидрирование H2C = CH2 + H2 — H3C, гидрогалогенирование H2C = CH2 + HBr — H3C — CH2Br, гидратацию H2C = CH2 + H20 — H3C — CH2OH. При этом есть три механизма разрыва: образование свободного радикала, иона, присоединение водорода к более гидрированному атому углерода (реакция полимеризации).
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
- Cu+Hg (NO3)2 — Hg+Cu (NO3)2.
- Fe+CuSO4 — Cu+FeSO4.
- ZnO + SO3 — ZnSO4.
- 2KBr+ Cl2 — 2KCl+ Br2.
- Ba + 2HCl — BaCl2 + H2.
- C2H6 + Cl2 — CH3CH2CL + HCL.
- CH3CH2Cl + KOH — CH3CH2OH + KCl.
- NаНСО3 + НСl = NаСl + Н2О + СО2
- Fe+ 2HCl — FeCl2+ H2.
- СrСl 3 + ЗNаОН — Сr (ОН) 3 + ЗNаСl.
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Карточки по теме реакции замещения
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Закончите уравнения химических реакций. Назовите вещества и укажите, простые они или сложные.
Реакции замещения – это …
Подчеркните металлы, которые будут взаимодействовать с соляной кислотой, используя при этом правило: металл способен вытеснять водород из кислот, только если он стоит в электрохимическом ряду напряжения металлов до водорода.
Mg, Cu, Al, Fe, Ag, Hg
Составьте уравнения возможных реакций. Укажите их тип.
Запишите уравнения возможных химических реакций, следуя правилу: металл вытесняет из растворов солей другие металлы, находящиеся в электрохимическом ряду напряжении металлов правее него, а сам может быть вытеснен металлом, расположенным левее него.
Определите исходные вещества по продуктам реакции. Расставьте коэффициенты. Укажите тип реакции.
Это реакции …., так как ….
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 939 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 23 человека из 14 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 588 947 материалов в базе
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 14.12.2020
- 114
- 1
- 14.12.2020
- 223
- 2
- 14.12.2020
- 80
- 0
- 14.12.2020
- 114
- 0
- 14.12.2020
- 85
- 0
- 14.12.2020
- 158
- 1
- 14.12.2020
- 167
- 7
- 14.12.2020
- 140
- 1
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 14.12.2020 627
- DOCX 13.6 кбайт
- 31 скачивание
- Оцените материал:
Настоящий материал опубликован пользователем Одрова Наталия Юрьевна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 3 года и 3 месяца
- Подписчики: 0
- Всего просмотров: 205029
- Всего материалов: 1112
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минобрнауки создаст для вузов рекомендации по поддержке молодых семей
Время чтения: 1 минута
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
Минпросвещения подключит студотряды к обновлению школьной инфраструктуры
Время чтения: 1 минута
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Только 23 февраля!
Получите новую
специальность
по низкой цене
Цена от 1220 740 руб. Промокод на скидку Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
http://nauka.club/khimiya/reaktsiy-zameshcheniya.html
http://infourok.ru/kartochki-po-teme-reakcii-zamesheniya-4659084.html