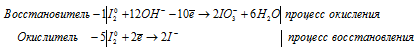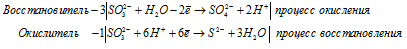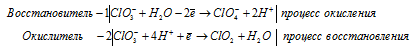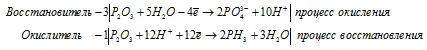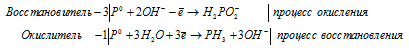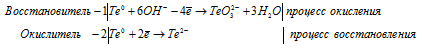Составление уравнений реакций самоокисления-самовосстановления (диспропорционирования)
Задача 634.
Закончить уравнения реакций самоокисления-самовосстановления (диспропорционирования):
а) I2 + Ba(OH)2 → Ba(IO3)2 +
б) K2SO3 → K2S +
в) HClO3 → ClO2 +
г) P2O3 + H2O → PH3 +
д) P + KOH + H2O → KH2PO2 + PH3
е) Te + KOH → K2TeO3 +
Решение:
Реакции диспропорционирования сопровождаются одновременным увеличением и уменьшением степени окисления одного и того же элемента, первоначально находившихся в одном, определённом состоянии.
а) I 2 + Ba(OH) 2 → Ba(IO 3) 2 +
После приведения членов обеих частей уравнения, получим:
б) K 2SO 3 → K 2S +
После приведения членов обеих частей уравнения, получим:
в) HClO 3 → ClO 2 +
После приведения членов обеих частей уравнения, получим:
г) P2O 3 + H 2 O → PH 3 +
После приведения членов обеих частей уравнения, получим:
д) P + KOH + H 2 O → KH 2 PO 2 + PH 3
После приведения членов обеих частей уравнения, получим:
е) Te + KOH → K 2 TeO 3 +
3Te 0 + 6OH — → TeO3 2- + 2Te 2- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Реакции самоокисления-самовосстановления
Различают 2 основных типа окислительно-восстановительных реакций:
а) межмолекулярные, в которых атомы окислителя и восстановителя находятся в составе разных частиц;
б) внутримолекулярные, в которых атомы окислителя и восстановителя находятся в одной частице.
Существует большая группа окислительно-восстановительных процессов, в которых окислителями и восстановителями являются атомы одного и того же элемента. Такие реакции называются реакциями самоокисления-самовосстановления или реакциями диспропорционирования.
Различают два вида таких процессов. Один из них — это дисмутация, при которой элемент из одной степени окисления переходит в две новых, меньшую и большую относительно исходной. Эти процессы чаще протекают в щелочной, реже в нейтральной среде. Примерами может служить уже описанная реакция хлора с растворами щелочей,а также реакция диоксида азота с щелочами:
Реакции дисмутации могут быть и внутримолекулярными:

3N +5 + 3e — → 3N +4 4
2O -2 – 4e — → O2 o 3
2. Разложение бертолетовой соли: KClO3 = KCl + KClO4
Второй вид процессов – это конмутация. В ходе этих процессов атомы одного и того же элемента из разных степеней окисления сходятся к одной, промежуточной между исходными. Реакции конмутации протекают, как правило, в кислой, реже в нейтральной среде.
Интересна реакции диоксида серы с сероводородом, используемая в промышленности:
Конечная степень окисления не обязательно будет нулевой. Вот еще пример:
Классификация окислительно-восстановительный реакций
- Реакции межатомного и межмолекулярного окисления-восстановления
- Реакции внутримолекулярного окисления-восстановления.
- Реакции диспропорционирования (реакции самоокисления-самовосстановления)
Рассмотрим каждый тип ОВР подробнее
Реакции межатомного и межмолекулярного окисления-восстановления
В реакциях данного типа перемещение электронов осуществляется между различными молекулами, атомами или ионами, т.е. окислитель и восстановитель являются различными веществами, например
Здесь MnO2 – окислитель, HBr — восстановитель
Реакции внутримолекулярного окисления-восстановления.
В реакциях такого типа перемещение электронов происходит внутри одного соединения, т.е. и окислитель и восстановитель входят в состав одного и того же сложного вещества (молекулы), например
Здесь Ag +1 – окислитель, O -2 – восстановитель.
Реакции диспропорционирования (реакции самоокисления-самовосстановления).
В реакциях этого типа окислителем и восстановителем являются атомы одного и того же элемента в одинаковой степени окисления (обязательно промежуточной). В результате образуются новые соединения, в которых атомы этого элемента обладают различной степенью окисления, например
Здесь N +3 (в молекуле HNO2) является и окислителем и восстановителем.
Наиболее распространенными и многообразными являются реакции первого типа (межатомного и межмолекулярного окисления-восстановления).
Как и для реакций обмена, для окислительно-восстановительных реакций возможно протекание в различных средах
• В растворах
• В газообразном состоянии
• C участием твердых веществ
http://helpiks.org/6-42473.html
http://zadachi-po-khimii.ru/obshaya-himiya/klassifikaciya-okislitelno-vosstanovitelnyj-reakcij.html