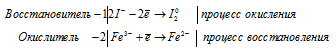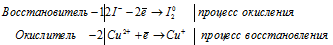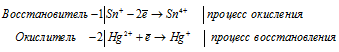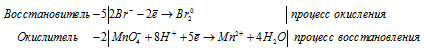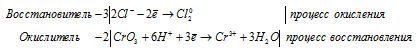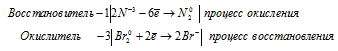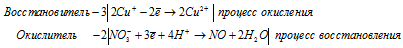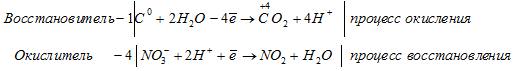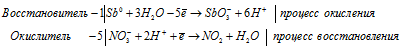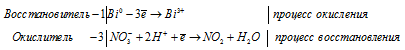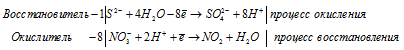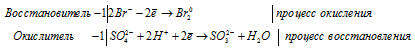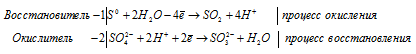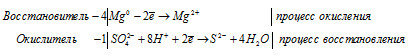Закончить уравнения реакций, в которых окислителем служит концентрированная серная кислота: а) HBr + H2SO4 → Вг2 +
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,296
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,189
- разное 16,831
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Составление уравнений окислительно-востановительных реакций
2I — + 2Fe 3+ = I2 + 2Fe 2+
После приведения членов обеих частей уравнения, получим:
б) KI + CuCl2 → CuCl +
2I — + 2Cu 2+ = I2 + 2Cu +
После приведения членов обеих частей уравнения, получим:
2KI + 2CuCl2 = I2 + 2CuCl + 2KCl.
Sn 2+ + 2Hg2+ = Sn 4+ + 2Hg +
После приведения членов обеих частей уравнения, получим:
Задача 630.
Закончить уравнения реакций, в которых окислитель (или восстановитель) дополнительно расходуется на связывание продуктов реакции:
а) HgBr + KMnO4 → MnВr2 +
б) HCl + CrO3 → Cl2 +
в) NH3(избыток) + Br2 → N2 +
г) Cu2O + HNO3 → NO +
Решение:
а) HgBr + KMnO4 → MnВr2 +
10Br — + 2MnO4 — + 16H + = 2Mn 2+ + 5Br2 0 + 8H 2 O.
После приведения членов обеих частей уравнения, получим:
б) HCl + CrO 3 → Cl 2 +
6Cl — + 2CrO3 + 12H + = 2Cr 3+ + 3Cl2 0 + 6H2O.
После приведения членов обеих частей уравнения, получим:
в) NH 3(избыток) + Br 2 → N 2 +
Ионно-молекулярная форма процесса:
2N -3 + 3Br2 0 = 6Br — + N2 0
После приведения членов обеих частей уравнения, получим:
г) Cu 2 O + HNO 3 → NO +
6Cu + + 2NO3 — + 8H + = 6Cu 2+ + 2NO + 4H2O.
После приведения членов обеих частей уравнения, получим:
Составление уравнений окислительно-востановительных реакций с участием концентрированной азотной кислоты
Задача 627.
Закончить уравнения реакций, в которых окислителем служит концентрированная азотная кислота:
а) С + HNO3 → CO2 +
б) Sb + HNO3 → HSbO3 +
в) Bi + HNO3 → Bi(NO3)3 +
г) PbS + HNO3 → PbSO4 + NO2 +
Решение:
а) С + HNO3 → CO2 +
После приведения членов обеих частей уравнения, получим:
б) Sb + HNO3 → HSbO3 +
После приведения членов обеих частей уравнения, получим:
Bi 0 + 3NO3 — + 6H + = Bi 3+ + 3NO2 + 3H2O
После приведения членов обеих частей уравнения, получим:
После приведения членов обеих частей уравнения, получим:
Задача 628.
Закончить уравнения реакций, в которых окислителем служит концентрированная серная кислота:
а) HBr + H2SO4 → Br2 +
б) S + H2SO4 → SO2 +
в) Mg + H2SO4 → MgSO4 +
Решение:
а) HBr + H2SO4 → Br2 +
Ионно-молекулярная форма процесса:
После приведения членов обеих частей уравнения, получим:
Ионно-молекулярная форма процесса:
После приведения членов обеих частей уравнения, получим:
4Mg 0 + SO4 2- + 8H + = 4Mg 2+ + S 2- + 4H2O
После приведения членов обеих частей уравнения, получим:
http://buzani.ru/zadachi/khimiya-glinka/1212-uravneniya-okislitelno-vostanovitelnykh-reaktsij-zadachi-629-630
http://buzani.ru/zadachi/khimiya-glinka/1211-kontsentrirovannaya-azothaya-kislota-kak-okislitel-zadachi-627-628