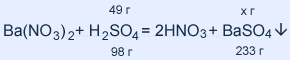Запишите уравнения реакций в молекулярном и ионном видах: H2SO4 + NaOH =
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 7598007
Пармезан Черница
Запишите уравнения реакций в молекулярной и сокращенной ионной форме:
a) ZnO б) NaOH в) H2SO4 г) SO3
Закончить уравнения возможных реакций naoh h2so4

Ca(HSO4)2, (CaOH)2SO4, Ca(NO3)2, NaH2PO4, Na3PO4, MgOHNO3.

Ca(NO3)2 = Ca 2+ + 2NO3 − нитрат кльция
Na3PO4 = 3Na + + PO4 3− фосфат натрия
Кислые соли
Ca(HSO4)2 = Ca 2+ + 2HSO4 − гидросульфат кальция
NaH2PO4 = Na + + H2PO4 − дигидрофосфат натрия
Основные соли
(CaOH)2SO4 = 2CaOH + + SO4 2− гидроксосульфат кальция
MgOHNO3 = MgOH + + NO3 − гидроксонитрат магния

а) HCl + Na2SO4 →
б) H3PO4 + CaCl2 →
в) FeCl3 + AgNO3 →
г) KNO3 + NaCl →
д) NaOH+ FeS →
е) KOH + Al2(SO4)3 →
ж) Ca + CuCl2 →
з) Cu + AgNO3 →
и) Mg + ZnS →
к) Cu + Fe(NO3)2 →
Если реакция не может быть осуществлена, объясните почему.

а) 2HCl + Na2SO4 = H2SO4 + 2NaCL 2H + +2Cl − + 2Na + + SO4 2− = 2H + + SO4 2− + 2Na + + 2Cl −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
г) KNO3 + NaCl = KCl + NaNO3 K + + 2NO 3 − + Na + + Cl − = K + + Cl − + Na + + NO 3 −
Реакция не идет так как: 1) не образуется воды, 1)не выделяется газ и 3) не выпадает осадок
ж) Cu + CuCl2 = CaCl2 + Cu
Ca 0 + Cu 2+ + 2Cl − = Ca 2+ + 2Cl − + Cu 0
Ca 0 + Cu 2+ = Ca 2+ + Cu 0
з) Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Cu 0 + 2Ag + + 2NO 3 − = Cu 2+ + 2 NO 3 − + 2Ag 0
Cu 0 + 2Ag + = Cu 2+ + 2Ag 0
и) Mg + ZnS ≠ MgS + Zn Реакция не идет т.к. ZnS и MgS нерастворимые соли
к) Cu + Fe(NO3)2 ≠ Реакция не идет т.к. в электрохимическом ряду напряжений Cu расположена правее Fe и не может вытеснять железо из его солей

| Дано: H2SO4, Ba(NO3)2 mр-ра= 980 г ω( H2SO4) = 0,05 mосад. =? | Решение: m(H2SO4) = mр-ра • ω( H2SO4) = = 980 • 0,05 = 49 г M(H2SO4) = 1 • 2 + 32 + 16 • 4 = 98 г / моль M(BaSO4) = 137 + 32 + 16 • 4 = 233г / моль 49 : 98 = х : 233; х = 116,5 г BaSO4 |


1. Fe + H2SO4 = FeSO4 + H2↑
2. FeO + H2SO4 = FeSO4 + H2O
3. Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
4. CuSO4 + Fe = FeSO4 + Cu
5. FeCO3 + H2SO4 = FeSO4 + CO2↑ + H2O

http://shkolenet.ru/QA/7598007/
http://reshebnikxim.narod.ru/ionobmen/41×8.html