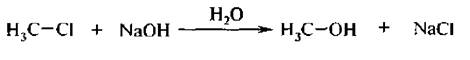
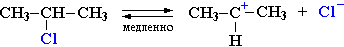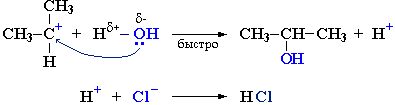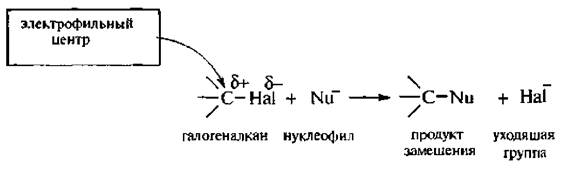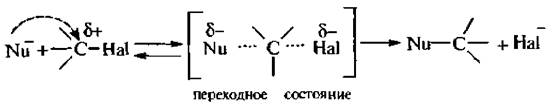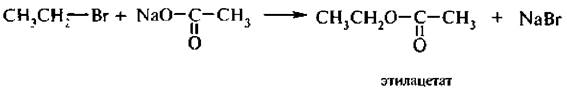Закончите схему уравнения механизма нуклеофильного замещения sn2
Замещение галогена происходит по одному из двух возможных механизмов. Рассмотрим эти механизмы на примере замещения галогена на гидроксильную группу (гидролиз галогеноуглеводородов) в изопропилхлориде (CH3)2CH–Cl под действием водного раствора щелочи:
(CH3)2CH–Cl + :OH – 
Механизм I (двухстадийный)
Cтадия 1. Алкилгалогенид, отщепляя галоген (электролитическая диссоциация), превращается в карбокатион:
Cтадия 2. Карбокатион взаимодействует с нуклеофилом (донором пары электронов) с образованием конечного продукта:
Стадия 1 является лимитирующей. Поскольку в ней участвует только одна частица (молекула галогеналкана), реакция считается мономолекулярной. Данный механизм обозначается символом SN1 (мономолекулярное нуклеофильное замещение).
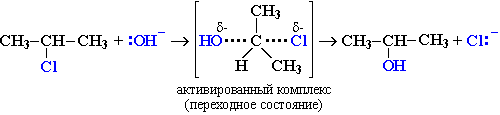
Механизм II (одностадийный)
Этот механизм нуклеофильного замещения заключается в практически одновременном отщеплении галогенид-иона и присоединении гидроксид-аниона (без образования карбокатиона) и идет в одну стадию:
Этот механизм называют бимолекулярным нуклеофильным замещением и обозначают символом SN2.
Механизм замещения зависит от строения реагентов и условий реакции. Для первичных галогеналканов предпочтительней одностадийный механизм (SN2), а для третичных – двухстадийный (SN1). Вторичные алкилгалогениды занимают промежуточное положение: механизм реакции зависит от условий ее проведения и может быть смешанным.
Как объяснить влияние строения галогеналкана на механизм реакции?
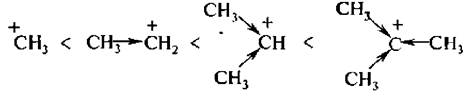
На лимитирующей стадии в механизме I (SN1) происходит образование карбокатиона. Чем стабильнее этот катион, тем легче он образуется. Третичный катион R3C + стабильнее, чем вторичный R2CН + и, тем более, первичный RCН2 + (три +I-эффекта алкильных групп R в третичном катионе, два – во вторичном и один – в первичном).
Механизм SN2
Вы будете перенаправлены на Автор24
Бимолекулярное нуклеофильное замещение $S_N2$ это одностадийный процесс, протекающий через переходное состояние (активированный комплекс):
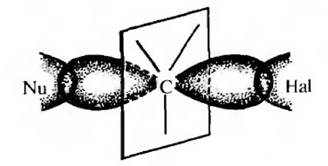
В исходном состоянии атом углерода, где происходит замещение, находится в состоянии $sp^3$ — гибридизации. Нуклеофильный реагент атакует положительный центр субстрата с электростатически наиболее выгодной «тыльной стороны», так как в этом случае на него не действует одноименный заряд атома $X$. Наименьшая энергия требуется при атаке атома углерода по прямой, соединяющей центр атомов $C$ и $X$. Момент, когда старая связь не разорвалась, а новая еще не образовалась, соответствует переходному состоянию. Центральный атом при этом находится в состоянии, близком к $sp^2$ — гибридизации.
Для достижения такого состояния требуется затрата энергии (энергия активации), поэтому переходному состоянию соответствует максимум энергии.
При дальнейшем превращении активированного комплекса в конечный продукт, снова происходит изменение гибридизации углеродного атома. Он имеет $sp^3$ — гибридизацию. Таким образом, реакция протекает с полным обращением конфигурации при реакционном центре.
Стереохимия процесса
При использовании оптически активного соединения после проведения реакции по $S_N2$ — механизму происходит инверсия (обращение) молекулы и образование оптического антипода. Здесь имеет место еальденоеское обращение.
Если подход со стороны, противоположной уходящей группе, невозможен вследствие особенностей реагирующих систем, например, полициклических соединений с уходящей группой в голове моста, то реакция $S_N2$ становится невозможной.
Готовые работы на аналогичную тему
В процессе реакции происходит изменение сольватации: уменьшается сольватация нуклеофила, так как уменьшается отрицательный заряд на нем, и увеличивается сольватация уходящей группы. Кроме того, при движении системы к активированному комплексу увеличивается роль дисперсионной сольватации, так как активированный комплекс более поляризован, чем исходное и конечное состояния.
Кинетика $S_N2$ процесса
Так как нуклеофил участвует в образовании переходного состояния, скорость реакции зависит как от природы, так и от концентрации нуклеофила. Кинетика $S_N2$ — процесса описывается уравнением второго порядка:
В тех случаях, когда в качестве нуклеофила используется молекула растворителя и концентрация нуклеофила практически не изменяется в процессе реакции, реакция может описываться уравнением первого порядка:
$r = k [Sol] [RX] = k'[RX]$.
Но реакция по-прежнему остается бимолекулярной, так как молекула растворителя включена в переходное состояние и происходит образование ковалентной связи.
Характеристика и примеры реакций проходящих по $S_N2$ механизму
К этому типу реакций относятся реакции нуклеофильного замещения, которые проходят по связи $C-Hal$ по общей схеме:
Для первичных и вторичных галогенпроизводных углеводородов механизм этой реакции следующий:
Нуклеофил $OH$-группа атакует асимметричный атом углерода ($C*$- электрофильный центр) с противоположной относительно галогена стороны с образованием плоского переходного состояния (ПС), который стабилизируется отщеплением галогенид-аниона. В приведенном примере замещение хлора происходит у асимметричного атома углерода, поэтому в ходе реакции происходит вращение конфигурации молекулы (Вальденивське вращения; Вальден, 1896 г.), которое уже рассматривалось ранее.
Реакция бимолекулярна, то есть скорость зависит как от концентрации субстрата так и реагента. Скорость этой реакции соответствует реакции второго порядка: $V = k\cdot [CH_3CH_2CH(Cl)CH_3] [OH^–]$.
К этому же типу реакций относятся реакции нуклеофильное замещение галогена, связанного с ароматическим ядром:
Реакция идет по $S_N2$ механизму, при этом роль сильного акцептора электронов, например, $NO_2$ заключается в увеличении положительного заряда $\delta+$ на атоме углерода, непосредственно связанном с галогеном.
Также по $S_N2$ механизму протекает широко известная реакция Мейера — получение алифатических нитросоединений реакцией алкилгалогенида и нитрита серебра.
По $S_N2$ механизму протекает множество других реакций.
Зависимость $S_N2$ нуклеофильного замещения от внешних факторов
В этих реакциях $S_N2$ нуклеофильное замещение зависит от ряда факторов:
Структуры субстрата (в данном случае галогеналкана). Так для первичных галогенпроизводных углеводородов ($R Hal$) характерен $S_N2$-механизм для вторичных и третичных $S_N1$.
Ряд реакционной способности субстратов в реакциях $S_N2$:
$PhCH_2X > EWG–CH_2X > CH_2=CHCH_2X > EtX >$
$> Me_2CHX > Me_3CX > > Me_3CCH_2X > CH_2=CHX > > PhX > HC(CH_2CH_2)_3CX$
Наиболее реакционноспособны в $S_N2$ реакциях бензильные, аллильные и пропанильные субстраты:
Нуклеофильности реагента и его концентрации. Чем больше нуклеофильность реагента, тем больше вероятность прохождения реакции по $S_N2$-механизму. Кроме этого, высокие концентрации способствуют $S_N2$-реакции, а низкие – $S_N1$.
Природа растворителя влияет на сольватацию исходных соединений и ионов, образующихся при диссоциации галогенпроизводных углеводородов. Оптимальные растворители для $S_N2$ реакций — апротонные полярные (DMF, DMSO; $CH_3CN$, ацетон).
В случае реакций с $S_N2$-механизмом менее полярное переходное состояние сольватируется меньше, чем исходные соединения. Поэтому с увеличением полярности растворителя скорость таких реакций уменьшается.
Природа галогена, который замещается, влияет на скорость реакции закономерно уменьшению поляризуемости связи $C-Hal$ в ряду: $R-I > R-Br > R-Cl >> R-F$.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 04 06 2021
Реакции нуклеофильного замещения
Способность галогеналкаиов вступать в реакции SN обусловлено полярностью связи углерод-галоген. Атом галогена, имея большую электроотрицаггельность, чем атом углерода, смешает на себя электронную плотность связи С-Hal. В результате атом галогена приобретает частичный отрицательный заряд (δ — ), а атом углерода – частичный положительный заряд (δ + ). Галогеналканы вступают в реакции с нуклеофильными реагентами, и при этом происходит замещение галогена на нуклеофил.
В зависимости от строения галогеналкана, природы нуклеофила и растворителя реакции SN протекают по двум основным направлениям: SN1 и SN2.
Механизм SN2 (бимолекулярное нуклеофильное замещение)
По механизму SN2 реагируют первичные и несколько труднее вторичные галогеналканы. Реакция протекает в одну стадию через образование переходного состояния. Вначале нуклеофил атакует атом углерода, связанный с галогеном (электрофильный центр), со стороны, противоположной связи С-Hal , т. е. атака идет с тыла, В результате происходит постепенное вытеснение нуклеофилом галогенид-иона (уходящей группы). Этот процесс включает переходное состояние, т. е. момент, когда связь С-Hal еще не разорвалась, а связь C-Nu еще не полностью образовалась.
Образование переходного состояния сопровождается изменением гибридного состояния атома углерода с sр 3 на sp 2 , Одна доля негибридизованной р-атомной орбитали атома углерода в переходном состоянии частично перекрывается с орбиталью атакующего нуклеофила, а вторая – с орбиталью атома галогена.
Возвращение атома углерода в sр 3 -гибридное состояние после отщепления галогенид-иона происходит с обращением конфигурации.
Протеканию реакции по механизму SN2 способствуют активные нуклеофильные реагенты – они легче образуют переходное состояние – и апротонные растворители. поскольку протонные полярные растворители сольватируют нуклеофил, тем самым снижая его реакционную способность.
По предложению английского химика К. Ингольда описанный механизм получил обозначение SN2. Буква S указывает на замещение. N – на нукдеофильный тип реакции, а цифра 2 обозначает, что реакция является бимолекулярной, т. е. в стадии, определяющей скорость реакции в целом (в данном случае образование переходного состояния), участвует два реагента (галогеналкан и нуклеофил). Скорость реакций, протекающих по механизму зависит от концентрации обоих реагентов.
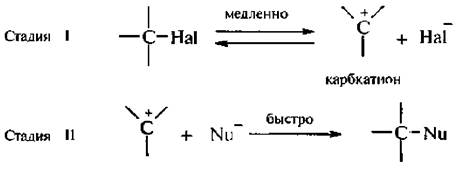
Механизм SN1 (мономолекулярное нуклеофильное замещение)
Поэтому механизму происходит нуклеофильное замещение в третичных и, в определенных условиях, во вторичных галогеналканах. В молекуле третичных галогеналканов объемные заместители при атоме углерода, связанном с галогеном, создают пространственные препятствия для подхода нуклеофила к электрофильному центру, и его атака с тыла становится невозможной. Вместе с тем третичные галоген-алканы способны в сильнополярных средах к ионизации. По механизму SN1 реакция протекает в две стадии:
На первой стадии происходит диссоциация молекулы галогеналкана при участии молекул протонного полярного растворители. В результате образуются карбкатион и галогенил-ион. Поскольку процесс ионизации протекает медленно, то 1 стадия определеят скорость всей реакции. На второй стадии образовавшийся карбкатион быстро реагируете нуклеофилом.
Протеканию реакции по механизму SN1 способствуют высокая ионизирующая и сольватирующая способность растворителя, а также стабильность образующегося карбкатиона. Устойчивость алкильных карбкатионов обусловлена делокализацией положительного заряда за счет +I-эффекта алкильных групп и возрастает в ряду:
Поэтому третичные галогенопроиэводные легче всего подвергаются ионизации.
Механизм нуклеофильного замещения, протекающий по рассмотренной схеме, называется мономолекулярным, т. к. на стадии, определяющей скорость всего процесса (стадия 1), принимает участие молекула только одного реагента – галогеналкана. Такой механизм обозначают SN1.
Таким образом, на основании вышеизложенного можно сделать вывод, что первичные галогеналканы обычно реагируют по механизму SN2, третичные – по механизму SNl. Вторичные галогеналканы, в зависимости от природы нуклеофила и растворителя, могут реагировать как по механизму SN2, так и по механизму SN1.
1. Гидролиз галогеналканов. Галогеналканы гидролизуются до спиртов. Реакцию обычно проводят в присутствии водных растворов щелочей, т. к. с водой она протекает медленно.
2. Реакция Вильямсона. Эта реакция является одним из лучших способов получения простых эфиров. Она заключается во взаимодействии галогеналканов с алкоголятами или фенолятами.
3. Взаимодействие с солями карбоновых кислот (ацетолиз). При действии солей карбоновых кислот на галогеналканы образуются сложные эфиры. Реакцию проводят в среде апротонного полярного растворителя.
4. Взаимодействие с аммиаком, алкил- и ариламинамц (аммонолиз и аминолиз). При взаимодействии с аммиаком и аминами галогеналка-ныадкилируют их с образованием смеси первичных, вторичных и третичных аминов, а также солей – четвертичных аммониевых оснований. Например, первичный амин образуется по схеме:
5. Взаимодействие с солями цианоаодородной кислоты. Первичные и вторичные галогеналканы с цианидом калия или натрия в среде апротонного полярного растворителя образуют нитрилы (SN2):
6. Взаимодействие с солями азотистой кислоты. Продукты, образующиеся в результате этой реакции, зависят от условий ее проведения, строения галогеналкана и соли.
http://spravochnick.ru/himiya/nukleofilnoe_zameschenie_u_nasyschennogo_atoma_ugleroda/mehanizm_sn2/
http://helpiks.org/5-46003.html