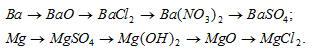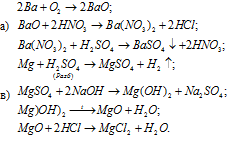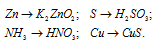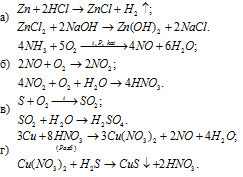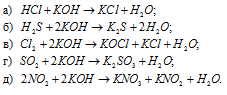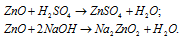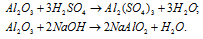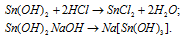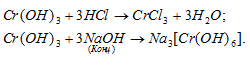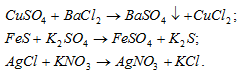Контрольная работа по теме: «Химические свойства кислот, оснований и солей как электролитов».
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«Актуальность создания школьных служб примирения/медиации в образовательных организациях»
Свидетельство и скидка на обучение каждому участнику
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 1.
1. Закончите уравнение химической реакции
А) Кислота + основание = Б) Основание + соль= В) Соль1 + соль2 = Г) Кислота + металл =
2.Закончите уравнение химической реакции:
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 1.
1. Закончите уравнение химической реакции
А) Кислота + основание = Б) Основание + соль= В) Соль1 + соль2 = Г) Кислота + металл =
2.Закончите уравнение химической реакции:
А) HCl + Ba ( OH )2=… Б )Al + CuSO4= … В )CaCO3+ HCl = … Г) H 2 SO 4 + Zn =…
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 1.
1. Закончите уравнение химической реакции
А) Кислота + основание = Б) Основание + соль= В) Соль1 + соль2 = Г) Кислота + металл =
2.Закончите уравнение химической реакции:
А) HCl + Ba ( OH )2=… Б )Al + CuSO4= … В )CaCO3+ HCl = … Г) H 2 SO 4 + Zn =…
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 1.
1. Закончите уравнение химической реакции
А) Кислота + основание = Б) Основание + соль= В) Соль1 + соль2 = Г) Кислота + металл =
2.Закончите уравнение химической реакции:
А) HCl + Ba ( OH )2=… Б )Al + CuSO4= … В )CaCO3+ HCl = … Г) H 2 SO 4 + Zn =…
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 2.
1. Закончите уравнение химической реакции
А) Кислота + металл = Б) Основание + соль= В) Соль + металл = Г) Кислота + соль =
2.Закончите уравнение химической реакции:
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 2.
1. Закончите уравнение химической реакции
А) Кислота + металл = Б) Основание + соль= В) Соль + металл = Г) Кислота + соль =
2.Закончите уравнение химической реакции:
А) HCl + Ca ( OH )2=… Б )Mg + CuSO4= … В )CaCO3+ HBr = … Г) H 2 SO 4 + Al =…
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 2.
1. Закончите уравнение химической реакции
А) Кислота + металл = Б) Основание + соль= В) Соль + металл = Г) Кислота + соль =
2.Закончите уравнение химической реакции:
А) HCl + Ca ( OH )2=… Б )Mg + CuSO4= … В )CaCO3+ HBr = … Г) H 2 SO 4 + Al =…
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Контрольная работа для 9 класс по теме: «Химические свойства кислот, оснований и солей как электролитов». Вариант 2.
1. Закончите уравнение химической реакции
А) Кислота + металл = Б) Основание + соль= В) Соль + металл = Г) Кислота + соль =
2.Закончите уравнение химической реакции:
А) HCl + Ca ( OH )2=… Б )Mg + CuSO4= … В )CaCO3+ HBr = … Г) H 2 SO 4 + Al =…
3.Напишите уравнение реакций, с помощью которых можно осуществить следующие превращения. Напишите молекулярное, полное ионное и сокращенное ионное уравнение:
4.Проведите химическую реакцию, напишите уравнение химической реакции и её результат.
5.Перед вами находиться вещество, к нему добавили несколько капель индикатора. Определите класс вещества и индикатор, объясните свой выбор.
Краткое описание документа:
Данная контрольная работа состоит из трех «теоретический» заданий, а также двух заданий «практических», для которых понадобятся реактивы. Для четвертого задания обучающемуся необходимо предоставить хотя бы два вещества, одним из которых точно должно являться соль / кислота / основание, а вторым и последующим — любой другой реагент. Для пятого задания самому учителю нужно подготовить пробирку, в котором уже находится соль / кислота / основание на выбор и несколько капель индикатора, также возможно использование индикаторной бумаги.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 949 человек из 80 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Курс добавлен 23.11.2021
- Сейчас обучается 48 человек из 28 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 33 человека из 19 регионов
Ищем педагогов в команду «Инфоурок»
Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 569 276 материалов в базе
Материал подходит для УМК
«Химия», Габриелян О.С., Остроумов И.Г., Сладков С.А.
Глава II. Химические реакции в растворах
Другие материалы
- 09.10.2021
- 80
- 0
- 09.10.2021
- 93
- 2
- 09.10.2021
- 43
- 2
- 09.10.2021
- 150
- 2
- 09.10.2021
- 99
- 1
- 09.10.2021
- 84
- 2
- 09.10.2021
- 55
- 0
- 09.10.2021
- 64
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 09.10.2021 2325
- DOCX 22.1 кбайт
- 74 скачивания
- Оцените материал:
Настоящий материал опубликован пользователем Сарварова Алёна Денисовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 2 года и 3 месяца
- Подписчики: 0
- Всего просмотров: 2928
- Всего материалов: 3
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Забайкалье в 2022 году обеспечат интернетом 83 школы
Время чтения: 1 минута
Тринадцатилетняя школьница из Индии разработала приложение против буллинга
Время чтения: 1 минута
Количество бюджетных мест в вузах по IT-программам вырастет до 160 тыс.
Время чтения: 2 минуты
Рособрнадзор не планирует переносить досрочный период ЕГЭ
Время чтения: 0 минут
В Воронеже продлили удаленное обучение для учеников 5-11-х классов
Время чтения: 1 минута
У 76% российских учителей оклад ниже МРОТ
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Как решать задачи с участием кислот и оснований
Задача 140.
Написать формулы ангидридов указанных кислот: H2SO4; H3BO3; Н4P2O7; НОСI; HMnO4.
Решение:
Ангидридами кислот называют оксиды, которые при взаимодействии с водой образуют кислоту.
H2SO4 – серная кислота, которой соответствует ангидрид SO3;
H3BO3 – ортоборная кислота, которой соответствует ангидрид B2O3;
H4P2O7 – тетраметафосфорная кислота, которой соответствует ангидрид P2O5;
HOCl – хлорноватистая кислота, которой отвечает ангидрид Cl2O;
HMnO4 – марганцевая кислота, которой отвечает ангидрид Mn2O7.
Задача 141.
Написать формулы оксидов, соответствующих указанным гидроксидам: H2SiО3; Сu(ОН)2; Н3АsО4; Н2WO4; Fе(ОН)3.
Решение:
H2SiО3 – кремниевая кислота, которой соответствует оксид SiO2;
Сu(ОН)2 – гидроксид меди (II), которому соответствует оксид CuO;
Н3АsО4 — мышьяковая кислота, которой соответствует оксид As2O5;
Н2WO4 – вольфрамовая кислота, которой соответствует оксид WO3;
Fе(ОН)3 – гидроксид железа (III), которому соответствует оксид Fe2O3.
Задача 142.
Составить уравнения реакций, с помощью которых можно осуществить указанные превращения:
Решение:
Задача 143.
Написать уравнения реакций, с помощью которых можно осуществить следующие превращения:
Решение:
Задача 144.
Какие из указанных газов вступают в химическое взаимодействие с раствором щелочи: НСI, Н2S, NO2, N2, С12, СН4, SO2, NH3? Написать уравнения соответствующих реакций.
Решение:
С раствором щёлочи в обычных условиях реагируют следующие газы: НСI, Н2S, NO2, С12, SO2. Азот (N2), метан (СН4) и аммиак (NH3) в обычных условиях не взаимодействуют с раствором buzani.ru/raznoe/stati/1594-klassifikatsiya-neorganicheskikh-veshchestv.
Уравнения реакций:
Задача 145.
Какие соли можно получить, имея в своем распоряжении CuSO4, AgNO3, К3PO4, ВаСI2? Написать уравнения реакций и назвать полученные соли.
Решение:
Имея в своём распоряжении CuSO4, AgNO3, К3PO4, ВаСI2 можно получить следующие соли:
а) При взаимодействии CuSO и К3PO4 образуется нерастворимая соль ортофосфат меди:
б) Реакция CuSO4 с ВаСI2 протекает с выпадением в осадок нерастворимого сульфата меди:
в) при взаимодействии AgNO3 и К3PO4 образуется нерастворимая соль фосфата серебра:
г) При сливании растворов AgNO3 и ВаСI2 выпадает осадок нерастворимого хлорида серебра:
д) При сливании растворов К3PO4 и ВаСI2 выпадает осадок нерастворимого ортофосфата бария:
Таким образом, можно получить следующие нерастворимые соли: Cu3(PO4)2 – ортофосфат меди (II); BaSO4 – сульфат бария; Ag3PO4 – ортофосфат серебра; AgCl – хлорид серебра; Ba3(PO4)2 – ортофосфат бария.
Задача 146.
Назвать следующие соединения: К2О2, МnO2, ВаО2, МnО, СrO3, V2O5.
Решение:
а) К2О2 – пероксид калия;
б) МnO2 — оксид марганца (IV);
в) ВаО2 – пероксид бария;
г) МnО – оксид марганца (II);
д) СrO3 – оксид хрома (VI);
е) V2O5 – оксид ванадия (V).
Задача 147.
Как доказать амфотерный характер ZnO, А12O3, Sn(ОН)2, Cr(ОН)3?
Решение:
а) ZnO – оксид цинка – амфотерный оксид, который реагирует с кислотами, образуя соль и воду, с основаниями – цинкаты.
б) А12O3 – оксид алюминия – амфотерный оксид, который реагирует с кислотами с образованием соли и воды, с основаниями – алюминаты.
в) Sn(ОН)2 – гидроксид олова (II) – амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с основаниями – тригидроксостаннаты (II).
г) Cr(ОН)3 – гидроксид хрома (III) амфотерный гидроксид, который реагирует с кислотами, образуя соль и воду, с концентрированным раствором NaOH – гексагидроксохроматы (III).
Задача 148.
Можно ли осуществить в растворах указанные ниже реакции:
Решение:
а) Хлорид бария и другие его растворимые соли являются качественными реактивами на обнаружение ионов SO4 2– В результате реакции выпадает осадок нерастворимого сульфата бария:
б) Сульфид железа нерастворимая соль, поэтому при приливании к нему раствора сульфата калия реакция не идёт. Потому что в растворе находятся только ионы K + и SO4 2- , которые образуются при диссоциации сульфата калия, как сильного электролита:
Ионы K + и SO4 2- не связываются с ионами воды H + , OH — и молекулами FeS – реакция не идёт.
в) AgCl – нерастворимая соль, поэтому при приливании к ней раствора KNO3 реакция не идёт. Потому что в растворе находятся только ионы K + и NO3 — , которые образуются при диссоциации сильного электролита нитрата калия:
Ионы K + и NO3 — не связываются с ионами воды H + , OH — и молекулами AgCl – реакция не идёт.
Урок №48. Химические свойства кислот
Химические свойства кислот
Универсальная индикаторная бумага
» jsaction=»rcuQ6b:WYd;»>
2.Реагируют с металлами в ряду активности до H 2 (искл. HNO 3 –азотная кислота)
Ме + КИСЛОТА =СОЛЬ + H 2 ↑ (р. замещения)
Zn + 2 HCl = ZnCl 2 + H 2
3. С основными (амфотерными) оксидами – оксидами металлов
Ме х О у + КИСЛОТА= СОЛЬ + Н 2 О (р. обмена)
КИСЛОТА + ОСНОВАНИЕ= СОЛЬ+ H 2 O ( р. обмена)
H 3 PO 4 + 3NaOH = Na 3 PO 4 + 3H 2 O
5. Реагируют с солями слабых, летучих кислот — если образуется кислота, выпадающая в осадок или выделяется газ:
2 NaCl (тв.) + H 2 SO 4 (конц.) = Na 2 SO 4 + 2HCl↑ ( р. обмена)
Сила кислот убывает в ряду:
HI > HClO 4 > HBr > HCl > H 2 SO 4 > HNO 3 > HMnO 4 > H 2 SO 3 > H 3 PO 4 > HF > HNO 2 >H 2 CO 3 > H 2 S > H 2 SiO 3 .
Каждая предыдущая кислота может вытеснить из соли последующую
6. Разложение кислородсодержащих кислот при нагревании ( искл. H 2 SO 4 ; H 3 PO 4 )
КИСЛОТА = КИСЛОТНЫЙ ОКСИД + ВОДА (р. разложения )
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются на газ и воду :
Сероводородная кислота в продуктах выделяется в виде газа:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Составьте уравнения реакций:
Назовите продукты реакции.
№2. Составьте уравнения реакций, назовите продукты:
№3. Составьте уравнения реакций взаимодействия кислот с основаниями и солями:
http://buzani.ru/zadachi/khimiya-glinka/1091-osnovaniya-i-kisloty-zadachi-140-148
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-48-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82