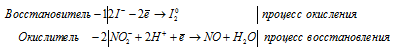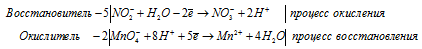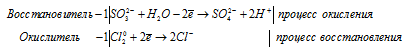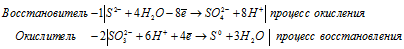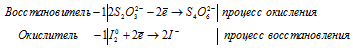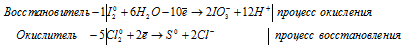Написать баланс и уравнять реакцию: KMnO4 + KNO2 + H2SO4 = MnSO4 + KNO3 + K2SO4 + H2O
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,297
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,223
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Составление уравнений реакций, характеризующих окислительно-восстановительную двойственность элементов
Задача 633.
Закончить уравнения реакций. Обратить внимание на окислительно-восстановительную двойственность элементов, находящихся в промежуточной степени окисленности:
а) KI + HNO2 + CH3COOH ⇒ NO +
KMnO4 + KNO2 + H2SO4 ⇒ KNO3 +
б) H2SO3 + Cl2 + H2O ⇒ H2SO4 +
H2SO3 + H2S ⇒ S +
в) Na2S2O3 + I2 ⇒ Na2S4O6 +
Cl2 + I2 + H2O ⇒ HIO3 +
Решение:
а)
1). KI + HNO2 + CH3COOH ⇒ NO +
После приведения членов обеих частей уравнения, получим:
2). KMnO 4 + KNO 2 + H 2SO 4 ⇒ KNO 3 +
После приведения членов обеих частей уравнения, получим:
В KNO3 атом азота находится в своей промежуточной степени окисления +4, поэтому KNO3 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 1), так и восстановителя (реакция 2).
б)
1). H 2 SO 3 + Cl 2 + H 2 O ⇒ H 2 SO 4 +
После приведения членов обеих частей уравнения, получим:
2). H 2 SO 3 + H 2 S ⇒ S +
После приведения членов обеих частей уравнения, получим:
В H2SO3 атом серы находится в своей промежуточной степени окисления +4, поэтому H2SO3 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 2), так и восстановителя (реакция 1).
в)
1). Na 2 S 2 O 3 + I 2 ⇒ Na 2 S 4 O 6 +
После приведения членов обеих частей уравнения, получим:
2). Cl 2 + I 2 + H 2 O ⇒ HIO 3 +
После приведения членов обеих частей уравнения, получим:
В I2 атом йода находится в своей промежуточной степени окисления 0, поэтому I2 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 1), так и восстановителя (реакция 2).
1 KL+KMnO4+H2SO4=I2+K2SO4+MnSO4H2O Решить задачу по ОВР 2 KNO2+H2SO4=KNO3+K2SO4+NO+H2O ОВР
да пробовала не получилось ((
Сама пробовала решать? Если да, то помогу .
10KI+2KMnO4+8H2SO4=5I2+6K2SO4+2MnSO4+8H2O2I^(-1)-2*1e=I2^(0) /5 полуреакция окисления, восстановитель I^(-1)Mn^(+7)+5e=Mn^(+2) /2 полуреакция восстановления, окислитель Mn^(+7)________________________10I^(-1)+2Mn^(+7)=5I2^(0)+2Mn^(+2)
3KNO2+H2SO4=KNO3+K2SO4+2NO+H2ON^(+3)-2e=N^(+5) /1 полуреакция окисления, окислитель N^(+3)N^(+3)+1e= N^(+2) /2 полуреакция восстановления, окислитель N^(+3)____________________________N^(+3)+2N^(+3)=N^(+5)+2N^(+2) преобразуем левую часть уравнения и получим:
3N^(+3)=N^(+5)+2N^(+2)
http://buzani.ru/zadachi/khimiya-glinka/1215-okislitelno-vosstanovitelnuyu-dvojstvennost-elementov-zadacha-633
http://sprashivalka.com/tqa/q/27924152