Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6de61aed78c61eeb • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составление ионно-молекулярной формы процесса окисления-восстановления с двумя окисляющимися элементами
После приведения членов обеих частей уравнения, получим:
Добавив в обе части равенства соответствующее количество ионов Н+ и NO3-, получим молекулярную форму процесса
4FeS2 + 15O2 0 + 24Н2О = 4Fe 3+ + 8SO3 + 48H + + 30O 2- .
Сорок восемь ионов водорода и двадцать четыре иона кислорода, соединяясь образуют двадцать четыре молекулы воды, получим:
После приведения членов обеих частей уравнения, получим:
Уравнение в молекулярной форме имеет вид:
4FeO . Cr2O3 + 7O2 0 + 16H2O = 4Fe 3+ + 8CrO4 2- + 14H + + 10O 2-
После приведения членов обеих частей уравнения, получим:
Так как в качестве исходного продукта в систему введён карбонат калия, то, подставив его в уравнение, получим:
Для получения полного уравнения после уравнивания калия получим:
4FeO . Cr 2 O 3 + 7O 2 0 + 2H 2 O + 8K 2 CO 3 = 4Fe 3+ + 8K 2 CrO 4 + 4H + + 8CO3 2-
С учётом того, что одним из продуктов реакции является углекислый газ, получим окончательную ионно-молекулярную форму уравнения реакции:
Уравнение в молекулярной форме будет имеет вид:
10FeSO3 + 6MnO4 — + 48H + + 10H2O = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 20H + + 24H2O
После приведения членов в обеих частях уравнения получим:
10FeSO3 + 6MnO4 — + 28H + = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 14H2O
Молекулярная форма имеет вид:
В данном процессе восстановитель содержит два окисляющихся элемента. Так FeSO3 содержит атом железа, который увеличивает свою степень окисления от +2 до +3, а атом серы от +4 до +6. При составлении уравнения электронно-ионного баланса число отданных электронов умножаем на 2, для того, чтобы привести к чётному значению числа атомов железа, серы и кислорода в формуле вещества Fe2(SO4)3.
Закончите уравнения возможных процессов, назовите продукты реакций: Fe + S ?
| Название | Закончите уравнения возможных процессов, назовите продукты реакций: Fe + S ? |
| Дата публикации | 05.11.2013 |
| Размер | 77.38 Kb. |
| Тип | Вопрос |
shkolnie.ru > Математика > Вопрос
| Примеры выполнения заданий Пример 1. Закончите уравнения возможных процессов, назовите продукты реакций: Fe + S ? Pt + O2 ? Na + H2 ? Al + Br2 ? Sr + P ? K + Ar ? Металлы (кроме золота и платины) взаимодействуют с неметаллами(кроме инертных газов) при обычных или повышенных температурах. При этом образуются бинарные соединения, в которых неметаллы проявляют отрицательную степень окисления.
Пример 2. Закончите уравнения возможных реакций металлов со сложными веществами: Решение. Металлы взаимодействуют со сложными веществами в зависимости от их положения в ряду напряжений. Так с растворами солей взаимодействуют металлы, начиная с магния, при этом они вытесняют правее стоящие металлы. С водой и растворами кислот-неокислителей взаимодействуют металлы стоящие в ряду напряжений до водорода.
Пример 3. Какие из металлов Na, Al, Au, Cu ,будут взаимодействовать с растворами NaOH и HNO3(разб.)? Из перечисленных металлов с растворами кислот и щелочей не взаимодействует золото. С раствором щелочи будет взаимодействовать только алюминий, т.к. его оксид и гидроксид обладают амфотерным характером. Разбавленная азотная кислота относится к кислотам-окислителям, поэтому она взаимодействует почти со всеми металлами (кроме Au, Pt), при этом степень восстановления азота из ее состава зависит от активности металла. 2Al +6H2O +6OH — = 2[Al(OH)6] 3- +3H2
Пример 4. Какой из находящихся в контакте металлов Zn-Co будет подвергаться коррозии в агрессивной среде? Напишите уравнения катодного и анодного процессов в а) кислой, б) нейтральной средах. При наличии контакта между металлами коррозии подвергается более активный из них, т.е. имеющий более низкое значение электродного потенциала. Этот металл будет анодом. В данном случае анодом является Zn, а катодом – Co. В зависимости от характера среды коррозия будет происходить с водородной или кислородной деполяризацией. а) в кислой среде:
б) в нейтральной среде:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
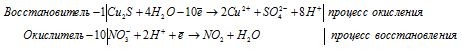
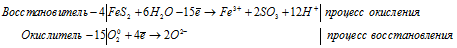
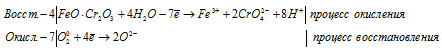
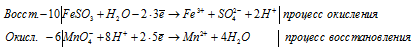
 Hg(NH3)4] 2+ Hg 2+ +4NH3
Hg(NH3)4] 2+ Hg 2+ +4NH3 10 -20
10 -20 10 -22
10 -22