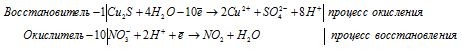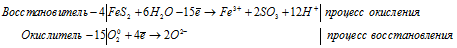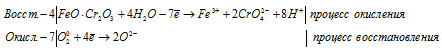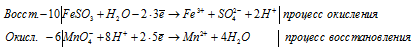Согласно термохимическому уравнению Fe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж при образовании 6 моль Fe3O4 в обратной реакции 1) выделяется 30 кДж 2) выделяется 60 кДж 3) поглощается 30 кДж 4) поглощается 90 ?
Химия | 5 — 9 классы
Согласно термохимическому уравнению Fe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж при образовании 6 моль Fe3O4 в обратной реакции 1) выделяется 30 кДж 2) выделяется 60 кДж 3) поглощается 30 кДж 4) поглощается 90 кДж P.
S : учитель написал, что правильный вариант ответа — 2).
Требует развернутого решения.
При прямой реакцииFe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж, Q выделяется, = > ; при обратной3Fe + 4CO2 = Fe3O4 + 4CO — 15Кдж Q будет поглощаться.
Q = n(Fe3O4) * Qмоль = 6 * 15 = 90 Кдж.
В соответствии с термохимическим уравнением : С6Н12О6 + 6О2 = = 6СО2 + 6Н2О + 2800кДж При образовании 12 моль углекислого газа : 1) Выделяется 2800 кДж теплоты ; 2) Поглощается 2800 кДж теплоты ; 3) В?
В соответствии с термохимическим уравнением : С6Н12О6 + 6О2 = = 6СО2 + 6Н2О + 2800кДж При образовании 12 моль углекислого газа : 1) Выделяется 2800 кДж теплоты ; 2) Поглощается 2800 кДж теплоты ; 3) Выделяется 5600 кДж теплоты ; 4) Поглощается 5600 кДж теплоты.
И если можно с пояснением.
Определите, выделяется или поглощается энергия в реакции H2 + Br2 = 2HBr а)при разрыве хим?
Определите, выделяется или поглощается энергия в реакции H2 + Br2 = 2HBr а)при разрыве хим.
Связи в молекулах Н2 поглощается 435, 9 кДж / моль энергии б) при разрыве хим.
Связи в молекулах Вr2 поглощается 192 кДж / моль энергии в) при образовании новой хим.
Связи в молекулах HBr выделяется 360 кДж / моль энергии.
Тепловые эффекты образования хлоридов алюминия и меди(II) соответственно равны 702?
Тепловые эффекты образования хлоридов алюминия и меди(II) соответственно равны 702.
4 кДж / моль 215.
Составьте термохимическое уравнение реакции.
При сгорании 0, 5 моль метана выделяется 440 кДж тепла?
При сгорании 0, 5 моль метана выделяется 440 кДж тепла.
Составьте термохимическое уравнение реакции горения метана.
Количества теплоты , выделяющееся при сгорании 2 моль угля(термохимическое уравнение С + О2 = СО2 + 393 кДж) равно : а) 393кДж б)786 кДж в)1179кДж с)196, 5 кДж д)3930 кДж заранее спасибо , можно с реш?
Количества теплоты , выделяющееся при сгорании 2 моль угля(термохимическое уравнение С + О2 = СО2 + 393 кДж) равно : а) 393кДж б)786 кДж в)1179кДж с)196, 5 кДж д)3930 кДж заранее спасибо , можно с решением.
Рассчитайте теплоту образования оксида алюминия, если при сгорании 5, 4 г алюминия выделяется 167, 37 кДж теплоты : а) 804 кДж / моль б) 3347, 4 кДж / моль в) 1676 кДж / моль г) 167, 4 кДж / моль?
Рассчитайте теплоту образования оксида алюминия, если при сгорании 5, 4 г алюминия выделяется 167, 37 кДж теплоты : а) 804 кДж / моль б) 3347, 4 кДж / моль в) 1676 кДж / моль г) 167, 4 кДж / моль.
При сгорание 0?
5 моль метана выделяется 440 кдж тепла.
Составьте термохимическое уравнение реакции горения метана.
Согласно термохимическому уравнению реакции CH4 + 2O2 = CO2 + 2H2O H = — 802 кДж определите, какой объем диоксида углерода будет выделяться, если при этом выделяется 1604 кДж?
Согласно термохимическому уравнению реакции CH4 + 2O2 = CO2 + 2H2O H = — 802 кДж определите, какой объем диоксида углерода будет выделяться, если при этом выделяется 1604 кДж.
Какая масса железа превратится в железную окалину, если при этом выделилось 112 кДж теплоты, а при образовании 1 моль окалины выделяется 1118 кДж теплоты?
Какая масса железа превратится в железную окалину, если при этом выделилось 112 кДж теплоты, а при образовании 1 моль окалины выделяется 1118 кДж теплоты?
Написать термохимическое уравнение горения алюминия, если при сгорание выделяется 1960 кдж тепла?
Написать термохимическое уравнение горения алюминия, если при сгорание выделяется 1960 кдж тепла.
На этой странице сайта, в категории Химия размещен ответ на вопрос Согласно термохимическому уравнению Fe3O4 + 4CO = 3Fe + 4CO2 + 15 Кдж при образовании 6 моль Fe3O4 в обратной реакции 1) выделяется 30 кДж 2) выделяется 60 кДж 3) поглощается 30 кДж 4) поглощается 90 ?. По уровню сложности вопрос рассчитан на учащихся 5 — 9 классов. Чтобы получить дополнительную информацию по интересующей теме, воспользуйтесь автоматическим поиском в этой же категории, чтобы ознакомиться с ответами на похожие вопросы. В верхней части страницы расположена кнопка, с помощью которой можно сформулировать новый вопрос, который наиболее полно отвечает критериям поиска. Удобный интерфейс позволяет обсудить интересующую тему с посетителями в комментариях.
Массу. Агрегатное состояние характерно для вещества.
ПРАВИЛЬНЫЙ ОТВЕТ ПЕРВЫЙ АГРЕГАТНОЕ СОСТОЯНИЕ.
Молярна маса FeSO4 = 152 г / моль Складемо наступну пропорцію із якої порахуємо масу заліза у 0. 1 г сульфату заліза Отже бачимо, що така маса сульфату заліза вдвічі перевищує його добову потребу.
Металлические, Ионные, Молекулярные, Атомные.
Металлические, Молекулярные, Атомные, Ионные.
Восстановление Fe3O4 оксидом углерода идет по уравнению Fe3O4(к) + CO(г) = 3FeO(к) + CO2(г). Вычислите ∆G0298 и сделайте вывод о возможности самопроизвольного протекания этой реакции






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Восстановление Fe3O4 оксидом углерода идет по уравнению
Вычислите ∆G 0 298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равно ∆S 0 298в этом процессе?
Решение :
Изменение энергии Гиббса рассчитаем по следствию из закона Гесса:
D G 0 х.р. = (3*(-239,3) + (-393,4)) — (-1017,0 -137,1) = 42,8 кДж
| Если вам нужно решить химию, тогда нажмите ➔ заказать контрольную работу по химии. |
| Похожие готовые решения: |
- Какие коррозионные процессы могут протекать при контакте двух металлов? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии. 181 Cu, Fe
- Какой объем раствора вещества A с массовой долей ω1, (плотность ρ1) следует взять для приготовления объема V2 раствора с массовой долей ω2(плотность ρ2)? Номер задачи 111
- Выберите исходные данные в таблице и приведите обоснованные ответы на вопросы. 1). Напишите электронную формулу невозбужденного атома элемента с зарядом ядра z. Номер задачи z n l 31 38 5 0
- Какие высшие степени окисления проявляют элементы третьего периода периодической системы: Na, Mg, Al, P, Cl? Напишите формулы оксидов и гидроксидов этих элементов в высшей степени окисления.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Составление ионно-молекулярной формы процесса окисления-восстановления с двумя окисляющимися элементами
После приведения членов обеих частей уравнения, получим:
Добавив в обе части равенства соответствующее количество ионов Н+ и NO3-, получим молекулярную форму процесса
4FeS2 + 15O2 0 + 24Н2О = 4Fe 3+ + 8SO3 + 48H + + 30O 2- .
Сорок восемь ионов водорода и двадцать четыре иона кислорода, соединяясь образуют двадцать четыре молекулы воды, получим:
После приведения членов обеих частей уравнения, получим:
Уравнение в молекулярной форме имеет вид:
4FeO . Cr2O3 + 7O2 0 + 16H2O = 4Fe 3+ + 8CrO4 2- + 14H + + 10O 2-
После приведения членов обеих частей уравнения, получим:
Так как в качестве исходного продукта в систему введён карбонат калия, то, подставив его в уравнение, получим:
Для получения полного уравнения после уравнивания калия получим:
4FeO . Cr 2 O 3 + 7O 2 0 + 2H 2 O + 8K 2 CO 3 = 4Fe 3+ + 8K 2 CrO 4 + 4H + + 8CO3 2-
С учётом того, что одним из продуктов реакции является углекислый газ, получим окончательную ионно-молекулярную форму уравнения реакции:
Уравнение в молекулярной форме будет имеет вид:
10FeSO3 + 6MnO4 — + 48H + + 10H2O = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 20H + + 24H2O
После приведения членов в обеих частях уравнения получим:
10FeSO3 + 6MnO4 — + 28H + = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 14H2O
Молекулярная форма имеет вид:
В данном процессе восстановитель содержит два окисляющихся элемента. Так FeSO3 содержит атом железа, который увеличивает свою степень окисления от +2 до +3, а атом серы от +4 до +6. При составлении уравнения электронно-ионного баланса число отданных электронов умножаем на 2, для того, чтобы привести к чётному значению числа атомов железа, серы и кислорода в формуле вещества Fe2(SO4)3.
http://natalibrilenova.ru/vosstanovlenie-fe3o4-oksidom-ugleroda-idet-po-uravneniyu-fe3o4k—cog—3feok—co2g-vyichislite-g0298-i-sdelajte-vyivod-o-vozmozhnosti-samoproizvolnogo-protekaniya-etoj-reaktsii-/
http://buzani.ru/zadachi/khimiya-glinka/1218-vosstanovitel-s-dvumya-okislyayushchimisya-elementami-zadacha-636