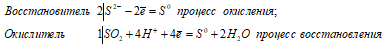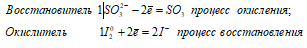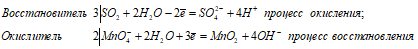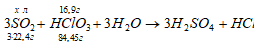Используя метод электронного баланса, составьте уравнения реакций Определите окислитель и восстановитель SO2 + KMnO4 + … → MnSO4 + … + H2SO4
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Характеристика окислительно-восстановительных свойств диоксида серы и сернистой кислоты
Задача 859.
Дать характеристику окислительно-восстановительных свойств диоксида серы и сернистой кислоты. Ответ подтвердить примерами.
Решение:
Сера в SO2 и H2SO3 находится в своей промежуточной степени окисления +4, поэтому SO2 и H2SO3 могут проявлять как восстановительные, так и окислительные
свойства.
а) Сера как восстановитель
Здесь степень окисления серы повышается от +4 до +6.
б) Сера как окислитель
Здесь степень окисления серы понижается от +4 до 0.
Задача 860.
Закончить уравнения реакций:
а) H2S + SO2 ↔ ;
б) H2SO3 + I2 ↔ ;
в) KMnO4 + SO2 + H2O ↔ ;
г) HIO3 + H2SO3 ↔ .
Указать, какие свойства проявляют в каждой из этих реакций диоксид серы или сернистая кислота.
Решение:
а) H2S + SO2 ↔ 3S↓ + 2H2O
Уравнения ионно-молекулярного баланса:
2S 2- + SO2 + 4H + = 3S 0 + 2H2O
Таким образом, диоксид серы проявляет свойства окислителя, а сероводород — восстановителя.
Таким образом, сернистая кислота проявляет свойства восстановителя.
3SO2 + 2MnO4 — + 10H2O = 3SO4 2- + 2MnO2 + 12H + + 8OH —
Таким образом, диоксид серы проявляет свойства восстановителя.
Восстановитель 3|6|SO3 2- + H2O — 2e = SO4 2- + 2H + процесс окисления
Окислитель 1|2|IO3 — + 6H + + 6e = I — + 3H2O процесс восстановления
3SO3 2- + IO3 — + 3H2O + 6H + ↔ 3SO4 2- + I — + 6H + + 3H2O
Таким образом, сернистая кислота проявляет свойства восстановителя.
Задача 861.
Какие из перечисленных осушителей можно использовать для удаления влаги из SO2: Н2SO4(конц.), КОН(к.), Р2O5(к.), К2CO3(к.)?
Решение:
а) Н2SO4(конц.) бурно реагирует с водой с образованием гидратов, в основном моногидратов:
б) SO2 как кислотный оксид реагирует с кристаллическим КОН с образованием кислой соли:
в) SO2 как кислотный оксид реагирует с кристаллическим К2СО3 с образованием соли сернистой кислоты и диоксида углерода:
г) Р2О5 бурно реагирует с водой с образованием фосфорной кислоты:
Таким образом, Н2SO4(конц.) и Р2О5 можно применить для осушения SO2.
Задача 862.
Сколько литров SO2, взятого при нормальных условиях, надо пропустить через раствор НСIО3, чтобы восстановить 16,9 г ее до НСI?
Решение:
Уравнение реакции имеет вид:
Рассчитаем объем SO2, необходимый для восстановления HCO3 из пропорции:
84,45 : (3 . 22,4) = 16,9 : x; x = [16,9 . (3 . 22,4)]/84,45 = 13,45 л.
Ответ: V(SO2) = 13,45 л.
Правила составления окислительно-восстановительных реакций
SO2 + KMnO4 + KOH → .
Вспоминаем, что перманганат калия является сильным окислителем, следовательно, он будет окислять оксид серы (IV). Также нужно помнить правило о том, как восстанавливается марганец в KMnO4 в различных средах:
| Среда: | Продукт восстановления |
|---|---|
| кислая среда: | Mn +2 (соль соответствующей кислоты) |
| нейтральная среда: | MnO2 |
| щелочная среда: | MnO4 2– |
Сера в ст. ок. +4 может окислиться только до ст. ок. +6, т.е. до сульфат-иона, так как реакция идет в растворе. Следовательно, мы точно знаем, что образуются MnO4 2– и SO4 2– . Предварительно запишем продукты реакции:
SO2 + KMnO4 + KOH → SO4 2– + MnO4 2–
Теперь необходимо составить уравнения процессов восстановления и окисления, используя правило, данное в самом начале этого раздела, начнем с окисления:
SO2 окисляется в SO4 2– , т.е. не хватает двух атомов кислорода. Следовательно, подходит строчка г) правила: нужно добавить гидроксид-ионы, которые и дадут нам недостающие атомы кислорода, в итоге образуя воду:
SO2 + OH – → SO4 2– + H2O
Следующим шагом уравниваем число атомов как в обычном химическом уравнении:
SO2 + 4OH – → SO4 2– + 2H2O
Затем уравниваем заряд, вычитая необходимое количество электронов, т.к это процесс окисления:
SO2 + 4OH – -2е  → SO4 2– + 2H2O
Теперь заряд 2- с обеих сторон полуреакции.
Аналогично поступаем с процессом восстановления. Так как MnO4 – превращается в MnO4 2– , нам не нужно ни прибавлять, ни связывать лишние атомы кислорода. В этом случае просто необходимо добавить один электрон:
MnO4 – + 1e → MnO4 2–
В итоге получаем следующие две полуреакции:
SO2 + 4OH – -2е  → SO4 2– + 2H2O
MnO4 – + 1e → MnO4 2–
Чтобы принимать и отдавать одинаковое количество электронов, второе уравнение нужно домножить на 2:
SO2 + 4OH – -2е  → SO4 2– + 2H2O
2MnO4 – + 2e → 2MnO4 2–
Складываем левые и правые части этих полуреакций:
SO2 + 4OH – -2е + 2MnO4 – + 2e → SO4 2– + 2H2O + 2MnO4 2–
SO2 + 4OH – + 2MnO4 –   → SO4 2– + 2H2O + 2MnO4 2–
На последнем шаге добавляем ионы, которые не изменили степень окисления, т.е. в данном случае K + :
SO2 + 4KOH + 2KMnO4  → K2SO4 + 2H2O + 2K2MnO4
Убеждаемся, что коэффициенты автоматически расставлены верно.
http://buzani.ru/zadachi/khimiya-glinka/1281-dioksid-sery-i-sernistaya-kislota-zadachi-859-862
http://chemrise.ru/theory/inorganic_11/reaction2