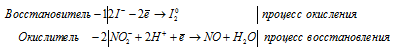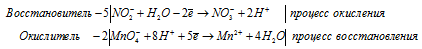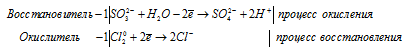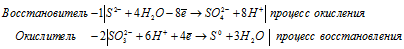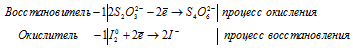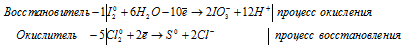Нитрат калия: способы получения и химические свойства
Нитрат калия KNO3 — соль щелочного металла калия и азотной кислоты. Белый. Плавится без разложения, при дальнейшем нагревании разлагается.
Относительная молекулярная масса Mr = 101,10; относительная плотность для тв. и ж. состояния d = 2,109; tпл = 334, 5º C;
Способ получения
1. Нитрат калия можно получить при 70º С путем взаимодействия надпероксида калия и оксида азота (IV), образуется нитрат калия и кислород:
2. В результате взаимодействия разбавленной азотной кислоты и гидроксида калия образуется нитрат калия и вода:
3. В результате реакции между горячим гидроксидом калия, оксидом азота (IV) и кислородом, происходит образование нитрата калия и воды:
4. В результате взаимодействия горячего и разбавленного раствора нитрита калия и кислорода образуется нитрат калия:
5. При смешивании горячего пероксида водорода и нитрита калия в разбавленной серной кислоте происходит образование нитрата калия и воды:
Качественная реакция
Качественная реакция на нитрат калия — взаимодействие с медью при нагревании в присутствии концентрированной кислоты:
1. При взаимодействии с серной кислотой и медью, нитрат калия образует сульфат калия, нитрат меди, газ оксид азота и воду:
Химические свойства
1. Hитрат калия разлагается при температуре 400–520º С с образованием нитрита калия и кислорода:
2. Н итрат калия может реагировать с простыми веществами :
2.1. Н итрат калия реагирует со свинцом при температуре 350–400 ºС . При этом образуется нитрит калия и оксид свинца:
KNO3 + Pb = KNO2 + PbO
2.2. Нитрат калия реагирует при температуре 400º С с алюминием с образованием алюмината калия, оксида алюминия и азота:
2.3. Нитрат калия взаимодействует с атомным водородом в присутствии цинка и разбавленной соляной кислоты при этом образуются нитрит калия и вода:
при взаимодействии нитрата калия и водорода при кипении в присутствии алюминия и концентрированного гидроксида калия образуется газ аммиак, вода и гидроксид калия:
3KNO3 + 8Al + 5KOH+ 18H2O = 3NH3↑ + 8K[Al(OH)4]
3. Возможны реакции между нитратом калия и сложными веществами :
3.1. Нитрат калия вступает в реакцию с кислотами :
3.1.1. В результате реакции в вакууме между нитратом калия и концентрированной серной кислотой образуется гидросульфат калия и азотная кислота:
3.2. Нитрат калия взаимодействует с солями :
3.2.1. Нитрат калия реагирует с сульфатом аммония при нагревании. В результате данной реакции образуются сульфат калия, оксид азота (I) и вода:
Составление уравнений реакций, характеризующих окислительно-восстановительную двойственность элементов
Задача 633.
Закончить уравнения реакций. Обратить внимание на окислительно-восстановительную двойственность элементов, находящихся в промежуточной степени окисленности:
а) KI + HNO2 + CH3COOH ⇒ NO +
KMnO4 + KNO2 + H2SO4 ⇒ KNO3 +
б) H2SO3 + Cl2 + H2O ⇒ H2SO4 +
H2SO3 + H2S ⇒ S +
в) Na2S2O3 + I2 ⇒ Na2S4O6 +
Cl2 + I2 + H2O ⇒ HIO3 +
Решение:
а)
1). KI + HNO2 + CH3COOH ⇒ NO +
После приведения членов обеих частей уравнения, получим:
2). KMnO 4 + KNO 2 + H 2SO 4 ⇒ KNO 3 +
После приведения членов обеих частей уравнения, получим:
В KNO3 атом азота находится в своей промежуточной степени окисления +4, поэтому KNO3 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 1), так и восстановителя (реакция 2).
б)
1). H 2 SO 3 + Cl 2 + H 2 O ⇒ H 2 SO 4 +
После приведения членов обеих частей уравнения, получим:
2). H 2 SO 3 + H 2 S ⇒ S +
После приведения членов обеих частей уравнения, получим:
В H2SO3 атом серы находится в своей промежуточной степени окисления +4, поэтому H2SO3 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 2), так и восстановителя (реакция 1).
в)
1). Na 2 S 2 O 3 + I 2 ⇒ Na 2 S 4 O 6 +
После приведения членов обеих частей уравнения, получим:
2). Cl 2 + I 2 + H 2 O ⇒ HIO 3 +
После приведения членов обеих частей уравнения, получим:
В I2 атом йода находится в своей промежуточной степени окисления 0, поэтому I2 в реакциях окисления-восстановления может проявлять свойства как окислителя (реакция 1), так и восстановителя (реакция 2).
Используя метод электронного баланса, составьте уравнение реакции NO2 + O2 + KOH → KNO3 + H2O Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,293
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,176
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://buzani.ru/zadachi/khimiya-glinka/1215-okislitelno-vosstanovitelnuyu-dvojstvennost-elementov-zadacha-633
http://www.soloby.ru/992598/%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D0%B5-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C