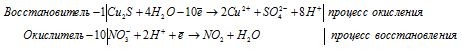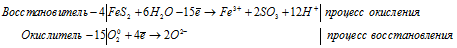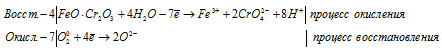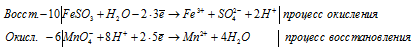Составление ионно-молекулярной формы процесса окисления-восстановления с двумя окисляющимися элементами
После приведения членов обеих частей уравнения, получим:
Добавив в обе части равенства соответствующее количество ионов Н+ и NO3-, получим молекулярную форму процесса
4FeS2 + 15O2 0 + 24Н2О = 4Fe 3+ + 8SO3 + 48H + + 30O 2- .
Сорок восемь ионов водорода и двадцать четыре иона кислорода, соединяясь образуют двадцать четыре молекулы воды, получим:
После приведения членов обеих частей уравнения, получим:
Уравнение в молекулярной форме имеет вид:
4FeO . Cr2O3 + 7O2 0 + 16H2O = 4Fe 3+ + 8CrO4 2- + 14H + + 10O 2-
После приведения членов обеих частей уравнения, получим:
Так как в качестве исходного продукта в систему введён карбонат калия, то, подставив его в уравнение, получим:
Для получения полного уравнения после уравнивания калия получим:
4FeO . Cr 2 O 3 + 7O 2 0 + 2H 2 O + 8K 2 CO 3 = 4Fe 3+ + 8K 2 CrO 4 + 4H + + 8CO3 2-
С учётом того, что одним из продуктов реакции является углекислый газ, получим окончательную ионно-молекулярную форму уравнения реакции:
Уравнение в молекулярной форме будет имеет вид:
10FeSO3 + 6MnO4 — + 48H + + 10H2O = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 20H + + 24H2O
После приведения членов в обеих частях уравнения получим:
10FeSO3 + 6MnO4 — + 28H + = 10Fe 3+ + 6Mn 2+ + 10SO4 2- + 14H2O
Молекулярная форма имеет вид:
В данном процессе восстановитель содержит два окисляющихся элемента. Так FeSO3 содержит атом железа, который увеличивает свою степень окисления от +2 до +3, а атом серы от +4 до +6. При составлении уравнения электронно-ионного баланса число отданных электронов умножаем на 2, для того, чтобы привести к чётному значению числа атомов железа, серы и кислорода в формуле вещества Fe2(SO4)3.
Контрольная работа по химии Неметаллы 8 класс
Контрольная работа по химии Неметаллы с ответами для учащихся 8 класса. Контрольная работа состоит из 3 вариантов в каждом по 5 заданий.
1 вариант
1. Закончите уравнения реакций:
Какие из этих реакций имеют практическое значение.
2. Осуществите превращения:
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: HBr, Na2S, MnO2 , Сl2. Приведите четыре уравнения реакций между этими веществами.
5. Определите массу осадка, образующегося при взаимодействии 400 г 15,6%-ного раствора сульфида натрия с избытком нитрата свинца.
2 вариант
1. Закончите уравнения реакций:
а) SO2 + O2 (в присутствии катализатора) = … ;
б) NH3 + HBr = … ;
в) O2 + Р = … ;
г) H2S + O2(избыток) = … ;
д) KBr + Cl2 = … .
Какие из этих реакций имеют практическое значение?
2. Осуществите превращения:
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: Н2SO4, CuO, Si, NaOH. Приведите четыре уравнения реакций между этими веществами.
5. Определите массу 19,6%-ного раствора серной кислоты, которая потребуется для получения 11,65 г сульфата бария.
3 вариант
1. Закончите уравнения реакций:
Какие из этих реакций имеют практическое значение?
2. Осуществите превращения:
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: H2S, SO2, O2, СаО. Приведите четыре уравнения реакций между этими веществами.
5. Через 243 г 10%-ного раствора бромоводорода пропустили 4,48 л (н.у.) хлора. Определи массу полученного брома.
Решите пожалуйста уравнения! Cu+O2 ->, CuO+HCl->, CuCL2+NaOH->, CuO+C->.
2Cu + O2 = 2CuO
CuO + 2HCl = CuCl2 + H2O
CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl
2CuO + C = 2Cu + CO2
1. CuO
2. CuCl+H2O
3. не точно CuOH + NaCl
4. CuC+ O
уравнять не помню как (((
2Cu+o2=2CuO
Штирлиц опередил )))
CО2 + 2NaOH = Na2СO3 + Н2О
СО2 — кислотный оксид, реагирует со щелоча
http://testschool.ru/2018/02/13/kontrolnaya-rabota-po-himii-nemetallyi-8-klass/
http://sprashivalka.com/tqa/q/162717