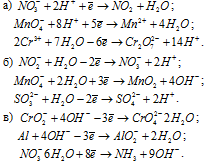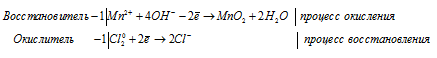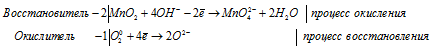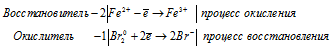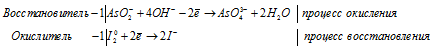Контрольная работа по химии Неметаллы 8 класс
Контрольная работа по химии Неметаллы с ответами для учащихся 8 класса. Контрольная работа состоит из 3 вариантов в каждом по 5 заданий.
1 вариант
1. Закончите уравнения реакций:
Какие из этих реакций имеют практическое значение.
2. Осуществите превращения:
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: HBr, Na2S, MnO2 , Сl2. Приведите четыре уравнения реакций между этими веществами.
5. Определите массу осадка, образующегося при взаимодействии 400 г 15,6%-ного раствора сульфида натрия с избытком нитрата свинца.
2 вариант
1. Закончите уравнения реакций:
а) SO2 + O2 (в присутствии катализатора) = … ;
б) NH3 + HBr = … ;
в) O2 + Р = … ;
г) H2S + O2(избыток) = … ;
д) KBr + Cl2 = … .
Какие из этих реакций имеют практическое значение?
2. Осуществите превращения:
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: Н2SO4, CuO, Si, NaOH. Приведите четыре уравнения реакций между этими веществами.
5. Определите массу 19,6%-ного раствора серной кислоты, которая потребуется для получения 11,65 г сульфата бария.
3 вариант
1. Закончите уравнения реакций:
Какие из этих реакций имеют практическое значение?
2. Осуществите превращения:
Укажите условия протекания реакций.
3. Закончите уравнение реакции:
Расставьте коэффициенты с помощью электронного баланса. Укажите окислитель и восстановитель.
4. Даны вещества: H2S, SO2, O2, СаО. Приведите четыре уравнения реакций между этими веществами.
5. Через 243 г 10%-ного раствора бромоводорода пропустили 4,48 л (н.у.) хлора. Определи массу полученного брома.
Составление уравнений полуреакций окисления с учетом кислотности среды
Задача 625.
Составить уравнения полуреакций окисления с учетом кислотности среды: 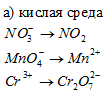
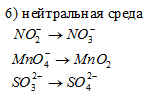
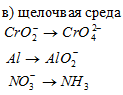
Решение:
Задача 626.
Закончить уравнения реакций:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
б) MnO2 + O2 + KOH = K2MnO4 +
в) FeSO4 + Br2 + H2SO4 =
г) NaAsO2 + I2 + NaOH = Na3AsO4 +
Решение:
а) Mn(OH)2 + Cl2 + KOH = MO2 +
Одна молекула Mn(OH)2 превращается в один ион Mn 2+ и два иона OH — :
Источником кислорода для протекания процесса превращения Mn 2+ в MnO2 служат ионы OH — в щелочной среде. Окислителем данного процесса являются атомы хлора из молекул Cl2.
Марганец повышает свою степень окисления от +4 до +6, т. е. проявляет свойства восстановителя, а кислород понижает свою степень окисления от 0 до -2, проявляя свойства окислителя.
Молекулярная форма процесса:
2Fe 2+ + Br2 0 = 2Fe 3+ + 2Br —
Молекулярная форма процесса:
г) NaAsO 2 + I 2 + NaOH = Na 3 AsO 4 +
AsO 2- + I2 0 + 4OH — = AsO4 3- + 2I — + 2H2O
Метод полуреакций (электронно-ионный)
Читайте также:
|
Следует иметь в виду, что в водных растворах связывание избыточного кислорода и присоединение кислорода восстановителем происходят по-разному в кислой, нейтральной и щелочной средах. В кислых растворах избыток кислорода связывается ионами водорода с образованием молекул воды, а в нейтральных и щелочных — молекулами воды с образованием гидроксид-ионов, например:
МnO4 − + 8Н + + 5 e = Мn 2+ + 4Н2O (кислая среда)
NO3 − + 6Н2О + 8 e = NН3 + 9OН — (нейтральная или щелочная среда)
Присоединение кислорода восстановителем осуществляется в кислой и нейтральной средах, за счет молекул воды с образованием ионов водорода, а в щелочной среде — за счет гидроксид-ионов с образованием молекул воды, например:
I2 0 + 6Н2О — 10 e = 2IO3 − + 12Н + (кислая или нейтральная среда)
СrO2 − + 4OН — — 3 e = СrO4 2- + 2Н2О (щелочная среда)
П р и м е р 4.Закончите уравнение реакций окисления сероводорода хлорной водой, протекающей по схеме:
Решение: В ходе реакции степень окисления хлора понижается от 0 до -1 (Cl2 восстанавливается), а серы — повышается от -2 до +6 (S -2 окисляется).
Уравнение полуреакции восстановления хлора:
При составлении уравнения полуреакции окисления S 2- исходим из схемы:
В ходе этого процесса атом серы связывается с четырьмя атомами кислорода, источником которых служат четыре молекулы воды. При этом образуется восемь ионов Н + ; кроме того, два иона Н + высвобождаются из молекулы H2S. Следовательно, всего образуется десять ионов водорода:
Левая часть схемы содержит только незаряженные частицы, а суммарный заряд ионов в правой части схемы равен +8. Следовательно, имеет место равенство:
Так как общее число принятых электронов окислителем должно быть равно общему числу отданных электронов восстановителем, надо первое уравнение умножить на 4, а второе — на 1:
В молекулярной форме полученное уравнение имеет следующий вид:
П р и м е р 5.Закончите уравнение реакции, протекающей по схеме:
Решение: В ходе реакции окисляются ионы мышьяка и серы: степень окисления мышьяка повышается от +3 до +5, а серы — от -2 до +6. При этом одна молекула As2S3 превращается в два иона AsO4 3− и три иона SO4 2−:
Источником кислорода, необходимого для протекания этого процесса, служат в кислой среде молекулы воды. Для образования двух ионов AsO4 3− требуется восемь молекул воды, а для образования трех ионов SO4 2− — еще двенадцать. Следовательно, всего в полуреакции окисления примут участие двадцать молекул воды, причем образуются сорок ионов водорода:
В левой части схемы заряженных частиц нет, а суммарный заряд частиц правой части равен +28;
таким образом, при окислении одной молекулы As2S3 отдается 28 электронов. Окончательно получаем уравнение полуреакции окисления в следующем виде:
При составлении уравнения полуреакции восстановления NO3 − исходим из схемы: NO3 − → NO.
В ходе этого процесса высвобождаются два атома кислорода, которые в кислой среде образуют две молекулы воды:
Суммарный заряд ионов в левой части схемы равен +3, а правая часть заряженных частиц не содержит. Следовательно, в процессе восстановления принимают участие три электрона:
Отношение чисел электронов, участвующих в процессах окисления и восстановления, равно 28 : 3.
Поэтому, суммируя уравнения полуреакций, первое из них умножаем на 3, а второе— на 28:
NO3 − + 4H + + 3 e = NO + 2H2O | 28 |
После приведения подобных членов в обоих частях уравнения получаем:
или в молекулярной форме:
П р и м е р 6. Используя метод полуреакций, составьте полные уравнения следующих окислительно-восстановительных реакций:
Решение:
а) MnO4 − — окислитель, восстанавливается в кислой среде до Mn 2+;
Fe 2+ — восстановитель, окисляется до Fe 3+ .
MnO4 − + 8H + + 5 e = Mn 2+ + 4H2O | 2 |
Fe 2+ — 2 e = Fe 3+ | 5 |
2MnO4 − + 16H + + 10Fe 2+ = 2Mn 2+ + 8H2O + 10Fe 3+
б) ClO3− — окислитель, восстанавливается до Cl−; Cl−- восстановитель, окисляется до Cl2:
ClO3 − + 6H + + 6e = Cl − + 3H2O | 1 |
2Cl − — 2e = Cl2 0 | 3 |
в) H2O — окислитель, восстанавливается до H2; Si — восстановитель, окисляется в щелочной среде до SiO3 2− :
2H2O + 2 e = H2 0 + 2OH − | 2 |
2Si 0 + 6OH − — 4 e = SiO3 2− + 3 H2O | 1 |
4H2O + Si 0 + 6OH − = 2H2 0 + 4OH − + SiO3 2− + 3 H2O
Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Студалл.Орг (0.007 сек.)
http://buzani.ru/zadachi/khimiya-glinka/1210-uravneniya-polureaktsij-okisleniya-zadachi-625-626
http://studall.org/all-147624.html