Закончите уравнение следующих реакций fe + h2so4 =?
Химия | 10 — 11 классы
Закончите уравнение следующих реакций fe + h2so4 =.
= feso4 + h2 и стрелочка вверх, т.
Закончите уравнение следующих реакций : Na2CO3 + HCl = NaOH + HCl = Fe(OH)3 + HNO3 = Mg + H2SO4 =?
Закончите уравнение следующих реакций : Na2CO3 + HCl = NaOH + HCl = Fe(OH)3 + HNO3 = Mg + H2SO4 =.
Закончить уравнения возможных реакций?
Закончить уравнения возможных реакций.
Закончите уравнения следующих реакций Zn(OH)2 + NaOH = Ag + HNO3 = FeCl2 + K2S =?
Закончите уравнения следующих реакций Zn(OH)2 + NaOH = Ag + HNO3 = FeCl2 + K2S =.
Закончите уравнения следующих реакций, назовите их типMg + H2SO4 -H3PO4 + K2CO3 -?
Закончите уравнения следующих реакций, назовите их тип
Химия : закончить уравнения реакции?
Химия : закончить уравнения реакции.
Закончить уравнение реакции?
Закончить уравнение реакции.
Закончите уравнения реакций схема?
Закончите уравнения реакций схема.
Закончите уравнения реакций, пожалуйста?
Закончите уравнения реакций, пожалуйста.
Закончите уравнения следующих реакций Fe + HCL = , Fe + (OH) 3 = , Li + H2O = , CuO + HNO3?
Закончите уравнения следующих реакций Fe + HCL = , Fe + (OH) 3 = , Li + H2O = , CuO + HNO3.
Закончите уравнения следующих реакций CaO + H2O?
Закончите уравнения следующих реакций CaO + H2O.
На этой странице сайта вы найдете ответы на вопрос Закончите уравнение следующих реакций fe + h2so4 =?, относящийся к категории Химия. Сложность вопроса соответствует базовым знаниям учеников 10 — 11 классов. Для получения дополнительной информации найдите другие вопросы, относящимися к данной тематике, с помощью поисковой системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям. Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы помогут найти нужную информацию.
Дано : m(O2) = 96 г М(О2) = 32 г / моль Vm = 22, 4 л / моль Найти : V(O2) n(O2) = m(O2) / M(O2) = 96 / 32 = 3 моль V(O2) = n(O2) * Vm = 3 * 22, 4 = 67, 2 л.
Дано : m(Zn) = 7 г V(H2) = 2, 24 л Найти : Содержит ли образец цинка примеси? Решение : Zn + 2HCl — > ZnCl2 + H2 n(H2) = V / Vm = 2, 24 л / 22, 4 л / моль = 0, 1 моль n(Zn) = n(H2) m(Zn)чист. = n * M = 0, 1 моль * 65, 37 г / моль = 6, 537 г Получае..
ОКИСЛИТЕЛЬНО — ВОССТАНОВИТЕЛЬНАЯ РЕАКЦИЯ.
6Li + N2 = 2Li3N вроде так.
6Li + N2 = 2Li3N И все .
1) поскольку у нас в формулеNa3PO4 атомов натрия 3, то количество веществаNa3PO4будет в 3 раза меньше чем кол — ва Na найдем кол — во(n)Na n(Na) = m / M = 23 / 23 = 1 моль, тогда n(Na3PO4) будет = n / 3 = 1 / 3 = 0. 33 моль 2)поскольку у нас в форму..
1) CH2 = CH — CH2 — CH2 — CH2 — CH3 гексен — 1 2) CH3 — CH = CH — CH2 — CH2 — CH3 гексен — 2 3) CH3 — CH2 — CH = CH — CH2 — CH3 гексен — 3 4) CH2 = C(CH3) — CH2 — CH2 — CH3 2 — метилпентен — 1 5) CH2 = CH — CH(CH3) — CH2 — CH3 3 — метилпентен — 1 6) ..
Дано : V(CO2) = 836мл m(C) = 0. 105г m(CuO) = 1. 4г w(HNO3) = 20% p(HNO3) = 1. 12г / мл Найти : V(HNO3) — ? Решение : CO2 + C — — — >2CO n(CO2) = V / Vm = 0. 836 / 22. 4 = 0. 0373моль M(C) = 12г / моль n(C) = m / M = 0. 105 / 12 = 0. 00875мо..
K + H2 = KH Li + CaO = не рааг.
BaCl₂ = Ba²⁺ + 2Cl⁻ при диссоциации 1 моль хлорида бария образуется 1 моль катионов 3Ca(OH)₂ = 3Ca²⁺ + 6OH⁻ при диссоциации 3 моль гидроксида кальция образуется 3 моль катионов Al₂(SO₄)₃ = 2Al³⁺ + 3SO₄²⁻ при диссоциации 1 моль сульфата алюминия образ..
Используя метод электронного баланса, составьте уравнение реакции H2SO4 + Fe → Fe2(SO4)3 + SO2 + H2O Определите окислитель и восстановитель
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,282
- разное 16,837
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Задачи и упражнения для самостоятельного решения. 25.1. Закончить уравнения реакций: а) Fe + H2SO4 (разб.) = ;
25.1. Закончить уравнения реакций: а) Fe + H2SO4 (разб.) = …;
б) Fe + HNO3 (оч. разб.) = …; в) Ni + H2SO4 (конц.) = …; г) Co + HCl = ….
25.2. Написать в молекулярном и ионном виде уравнения реакций взаимодействия гидроксидов железа (II), кобальта (II) и никеля (III) с соляной кислотой.
25.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
25.4. Могут ли в растворе находиться совместно следующие вещества:
Для взаимодействующих веществ составить уравнения реакций.
25.5. Восстановление Fe3O4 оксидом углерода идет по уравнению
Вычислить ΔG°х.р. и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры?
( 
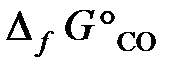


25.6. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
25.7. Закончить уравнения реакций: а) Fe(OH)2 + O2 + H2O = …;
25.8. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
25.9. Какие степени окисления проявляет железо в своих соединениях? Как можно обнаружить ионы Fe 2+ и Fe 3+ в растворе? Составить молекулярные и ионные уравнения соответствующих реакций.
25.10. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей: а) FeCl2 + H2O ↔ …; б) NiSO4 + H2O ↔ …;
25.11. Закончить уравнения реакций получения ферратов калия и бария (K2FeO4, BaFeO4): а) KOH + FeCl3 + Br2 = K2FeO4 + …;
25.12. Закончить уравнения реакций образования комплексных соединений и назвать их, учитывая, что координационное число железа равно 6, а кобальта и никеля 4. а) Fe(CN)2 + KCN = …;
25.13. Сколько часов надо вести электролиз раствора FeSO4, чтобы при силе тока в 2 А выделилось 279,2 г чистого железа? (Ответ: 133,6 ч).
25.14. Рассчитать молярную массу эквивалентов и эквивалент восстановителя в реакции Fe(OH)2 + KMnO4 + H2O = ….
25.15. Определить тепловой эффект реакции 4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
если в реакции участвует 59,2 г FeS2, а энтальпии образования реагирующих веществ равны: 
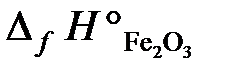
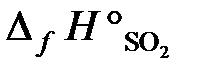
25.16. Состав комплексной соли кобальта выражается эмпирической формулой CoCl3∙4NH3. При взаимодействии с нитратом серебра осаждается лишь одна треть содержащегося в соли хлора. Учитывая, что координационное число кобальта в этом соединении 6, определить, какие лиганды входят в состав комплексного иона и написать координационную формулу соли.
25.17. По стандартным энтальпиям образования веществ вычислить тепловой эффект реакции, протекающей при выплавке чугуна,
( 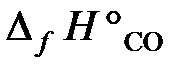



25.18. Закончить в молекулярном и ионном виде уравнения качественных реакций на ион Fe 3+ : а) Fe2(SO4)3 + KOH = …; б) FeCl3 + K4[Fe(CN)6] = …;
25.19. Закончить уравнения реакций: а) FeSO4 + Br2 + H2SO4 = …;
25.20. Как влияет на коррозию железа его контакт с другими металлами? Какой металл будет разрушаться первым при повреждении поверхности а) луженого, б) оцинкованного; в) никелированного железа? Составить схемы образующихся гальванических элементов. Написать уравнения реакций катодных и анодных процессов.
Галогены
Теоретическое введение
Галогены − фтор, хлор, бром, йод, астат − расположены в главной подгруппе VП группы. Атомы галогенов на внешнем уровне имеют по семь электронов (ns 2 np 5 ). Характерная степень окисления галогенов −1. Однако все они, кроме фтора, могут проявлять и положительные степени окисления +1, +3, +5, +7. В природе галогены встречаются главным образом в виде отрицательно заряженных ионов, и их получение в свободном состоянии сводится к окислению этих ионов. В качестве окислителей используют МnО2, PbО2, KMnO4, K2Cr2O7, KClO3.
Двухатомные молекулы галогенов неполярны, поэтому они хорошо растворимы в неполярных или слабополярных жидкостях: сероуглероде, бензине, бензоле, хлороформе. Растворимость галогенов в воде сравнительно мала. Фтор в воде не может быть растворен, так как он ее окисляет. В одном объеме воды при 20 °С растворяется 2,5 объема хлора. Этот раствор называется хлорной водой. Растворенный в воде хлор взаимодействует с ней с образованием хлорноватистой НClO и соляной кислот. Хлорноватистая кислота неустойчива и разлагается с образованием атомарного кислорода, вследствие чего хлорная вода обесцвечивает красители.
Йод лучше растворяется в растворе иодида калия. В качестве индикатора для определения йода применяют раствор крахмала. С крахмалом йод образует адсорбционные окрашенные соединения синего цвета, окраска которых исчезает при нагревании.
Свободные галогены являются энергичными окислителями, вступая в реакции с большинством элементов. Окислительная активность галогенов уменьшается от фтора к йоду.
Отрицательные ионы галогенов являются восстановителями (за исключением F ‾ ), причем их восстановительная способность увеличивается от С1 − ∙ к I − .
Соединения галогенов с водородом – галогеноводороды – бесцветные газы с резким запахом, хорошо растворимы в воде. Их растворы являются кислотами. В ряду HF − НCl − НBr − HI кислотные свойства усиливаются. В этом же ряду возрастает восстановительная активность.
HCl и HF получают обменной реакцией их солей с концентрированной H2SO4. НBr и HI подобным образом получить практически невозможно, так как в реакции с серной кислотой они проявляют сильные восстановительные свойства и окисляются до свободных галогенов. НВг и HI получают гидролизом соединений фосфора PBr3 и PI3.
Кислородные соединения галогенов могут быть получены только косвенным путем. Они представляют собой сравнительно малоустойчивые вещества и являются сильными окислителями.
http://www.soloby.ru/992452/%D0%B8%D1%81%D0%BF%D0%BE%D0%BB%D1%8C%D0%B7%D1%83%D1%8F-%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD%D0%BD%D0%BE%D0%B3%D0%BE-%D0%BE%D0%BF%D1%80%D0%B5%D0%B4%D0%B5%D0%BB%D0%B8%D1%82%D0%B5-%D0%BE%D0%BA%D0%B8%D1%81%D0%BB%D0%B8%D1%82%D0%B5%D0%BB%D1%8C-%D0%B2%D0%BE%D1%81%D1%81%D1%82%D0%B0%D0%BD%D0%BE%D0%B2%D0%B8%D1%82%D0%B5%D0%BB%D1%8C
http://lektsii.org/7-71581.html









