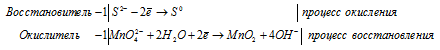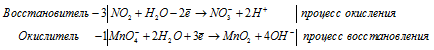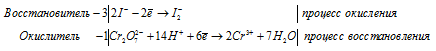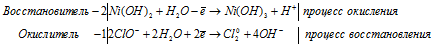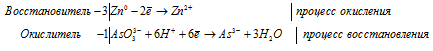Закончите уравнения следующих реакций: 1)k2o2+ki+h2so4-> 2)k2o2+kmno4+h2so4–> 3)kbr+h2so4-> so2+ 4)ki+h2so4-> h2s+ 5)kcio3+kno2->
Ответы
в воде лёд естественно плавает. а вот как его использовали я уж не знаю. извини но поставь мне .. я набираю и добавляю в друзья
но , я искренне извиняюсь за то что не смогла
не дабавляй меня в нарушение
1)0.4*6=2.4м-ушло на 6 юбок.
2)3.6-2.4=1.2м-ушло на 4 блузки.
3)1.2: 4=0.3м-ушло на одну блузку.
запах леса, статуя из бронзы, памятник из мрамора, плавательный бассейн, тренировочный костюм, увлечённо рассказывать, держаться достойно, привокзальная гостиница, приморский парк, передвигаться по полю, ехать вдоль берега.
Составление уравнений в ионно-молекулярной форме
S 2 — + MnO4 2- + 2H2O = MnO2 + S 0 + 4OH —
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
4K + + S 2- + MnO4 2- + 2H2O = S + MnO2 + 4K + + 4OH — .
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Для уравнивания добавим в уравнение 1 моль K2SO4, получим:
Уравнение в ионно-молекулярной форме:
После приведения членов обеих частей уравнения, получим:
Уравнение в ионно-молекулярной форме:
3Zn 0 + AsO3 3- + 6H + = 3Zn 2+ + As 3- + 3H2O.
После приведения членов обеих частей уравнения, получим:
Примеры решения задач. Закончите уравнение реакции и подберите коэффициенты методом электронного баланса: KI + KMnO4 + H2SO4 = I2 + .
Пример 1.
Закончите уравнение реакции и подберите коэффициенты методом электронного баланса: KI + KMnO4 + H2SO4 = I2 + ….
1. Дописываем уравнение реакции:
2. Определяем степени окисления в реагентах и продуктах, находим элементы, которые изменили свои степени окисления:
3. Составляем уравнения электронного баланса:
2I -1 – 2e ® I2 ï 5 восстановитель, окисление;
Mn +7 + 5e ® Mn +2 ï 2 окислитель, восстановление.
4. Проставляем коэффициенты с учетом множителей:
5. Подбирают коэффициенты для остальных участников реакции:
Пример 2.
Закончите уравнение реакции, подберите коэффициенты методом электронно-ионного баланса, и рассчитайте эквивалентую массу окислителя: NaCrO2 + NaOH + H2O2 → ….
3) Составим частные электронно-ионные уравнения /полуреакции/:
Для процесса окисления хромата натрия:
б/ CrO2 — + 4OH → CrO 2- 4 + 2H2O, /подведение баланса вещества/
в/ CrO2 — + 4OH — — 3е → CrO 2- 4 + 2H2O. /соблюдение равенства зарядов/
Для процесса восстановления пероксида водорода:
4) Подведем баланс зарядов и выведем коэффициенты:
CrО — 2 + 4OH — — 3е → CrO4 2- + 2H2O, окисление │2;
H2O2 + 2е → ОН — , восстановление │3.
5) Суммируем частные уравнения реакций окисления и восстановления после умножения на соответствующие коэффициенты:
6) Приведение подобных членов и сокращение:
(в данном случае сокращение не требуется)
7) Записываем уравнение реакции в молекулярном виде с учетом полученных коэффициентов:
8) Проверяем баланс по элементам в молекулярном уравнении. В данном случае никаких уточнений не требуется.
9) Рассчитаем молярную массу эквивалента окислителя, в данном случае пероксида водорода:
Э = М/z, где М – молярная масса Н2О2, равная 34 г/моль, z – число переносимых электронов.
Пример 3.
Напишите уравнения реакций между перманганатом калия и сульфитом калия в кислой, щелочной и нейтральной средах. Уравняйте методом электронно-ионного баланса.
MnO4 — + 8H + + 5е → Mn 2+ + 4H2O, восстановление | 2
SO3 2- + H2O – 2е → SO4 2- + 2H + , окисление | 5
б) Щелочная среда
MnO4 — + е → MnO4 2- , восстановление | 2
SO3 2- + 2OH — — 2е → SO4 2- + H2O, окисление | 1
в) Нейтральная среда
MnO4 — + 2H2O + 3е → MnO2 + 4OH — , восстановление | 2
SO3 2- + 2OH — — 2е → SO4 2- + 2H2O, окисление | 3
Пример 4.
В каком направлении в стандартных условиях будет протекать реакция: КСl + Br2 = KBr + Cl2? j (Br2 0 /2Br — ) = +1,09В, j (Cl2 0 /2Cl — ) = +1,36В.
Решение: Для определения направления реакции рассчитаем ее ЭДС. Для этого определим, что является окислителем, а что является восстановителем:
КСl -1 + Br2 0 = KBr -1 + Cl2 0 ; Сl -1 – отдает свои электроны, следовательно, является восстановителем, Br2 – окислителем.
ЭДС рассчитываем по формуле: ∆E 0 = j 0 ок-ля – j 0 вос-ля = 1,36 – 1,09 = 0,28 > 0. Т.к. ЭДС реакции больше нуля, то она протекает самопроизвольно в прямом направлении.
Ответ: реакция протекает самопроизвольно в прямом направлении.
Пример 5.
Рассчитайте молярную концентрацию нитрита натрия, если на титрование 20 мл его раствора, пошло 12,5 мл 0,01 М раствора дихромата калия в кислой среде.
Для расчета нормальной концентрации дихромата калия запишем уравнение протекающей реакции и уравнения полуреакций:
2Cr +6 + 6e ® 2Cr +3
Рассчитаем нормальную концентрацию K2Cr2O7:
где z – число переносимых электронов.
Найдем концентрацию нитрата натрия по закону эквивалентов:

Перейдем к молярной концентрации нитрата натрия по формуле:
СМ = СN / z = 0,0375/2 = 0,01875 моль/л.
Ответ: 0,01875 моль/л.
Дата добавления: 2016-01-09 ; просмотров: 6337 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
http://buzani.ru/zadachi/khimiya-glinka/1213-uravneniya-v-ionno-molekulyarnoj-forme-zadachi-640
http://helpiks.org/6-48102.html