Урок 11. Формулировка закона сохранения массы и энергии
В уроке 11 «Формулировка закона сохранения массы и энергии» из курса «Химия для чайников» дадим определение закону сохранения массы и закону сохранения энергии, познакомимся с открытием Ломоносова, а также повторим некоторые основы химии из прошлой главы. Этим уроком мы открываем следующий раздел курса, под названием «Закон сохранения массы и энергии». Поэтому, чтобы у вас не возникало вопросов по урокам, обязательно изучите все уроки из первого раздела «Атомы, молекулы и ионы».
Мысль о том, что все в мире состоит из атомов, зародилась еще до нашей эры. Древнегреческий философ Демокрит полагал, что вся материя состоит из неделимых микрочастиц — атомов, что каждый атом обладает индивидуальными свойствами, что свойства веществ определяются их взаимным расположением относительно друг друга. Таким образом его идеи являются примитивным вариантом того, что изложено в разделе 1 «Атомы, молекулы и ионы». Напрашивается вопрос: почему же тогда древние греки не воспользовались гипотезой Демокрита и не научились получать атомную энергию? Почему прошло еще 2000 лет, прежде чем наука достигла своего современного уровня? Одна из причин заключалась в том, что древние греки понятия не имели о законах сохранения вещества, ну и конечно же о законе сохранения энергии.
Закон сохранения массы и энергии
Великий русский ученый М.В. Ломоносов в 1748 году стал первым, кто осознал, что масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. Он установил закон который гласит, что суммарная масса всех продуктов химического превращения должна точно совпадать с суммарной массой исходных веществ. Помимо суммарной массы веществ, в химических реакциях сохраняется также число атомов каждого сорта независимо от того, в сколь сложных превращениях они участвуют и как переходят из одних молекул в другие.
В химических реакциях должна сохраняться также и энергия. Химически важный вывод из этого закона заключается в том, что поглощение или выделение тепла (теплота реакции) в конкретной химической реакции не зависит от того, каким путем осуществляется реакция — в одну или несколько стадий. Например, тепло, выделяющееся напрямую при сгорании газообразного водорода и графита (одна из форм углерода), должна совпадать с теплом, выделяющимся, когда водород и углерод используются для получения синтетического бензина, а заем этот бензин используется в качестве топлива. Если бы количество тепла, выделяемого в одной из двух описанных выше вариантов реакции, было неодинаковым, можно было бы воспользоваться этим и проводить более эффективную реакцию в одном направлении, а менее эффективную — в обратном. В результате получился бы циклический бестопливный источник тепла, непрерывно дающий даровую энергию. Но это всего лишь мечты о вечном двигателе, создание которого разрушается об незыблемую стену закона сохранения массы и энергии.
Закон сохранения массы: в процессе химической реакции не происходит образования или разрушения атомов.
Закон сохранения энергии: если сумма двух реакций представляет собой новую, третью реакцию, то теплота третьей реакции равна сумме теплот первых двух реакций. Говорят, что тепловые эффекты реакций аддитивны. Более подробно о законе сохранения тепла вы узнаете в конце данной главы, где все станет просто и ясно.
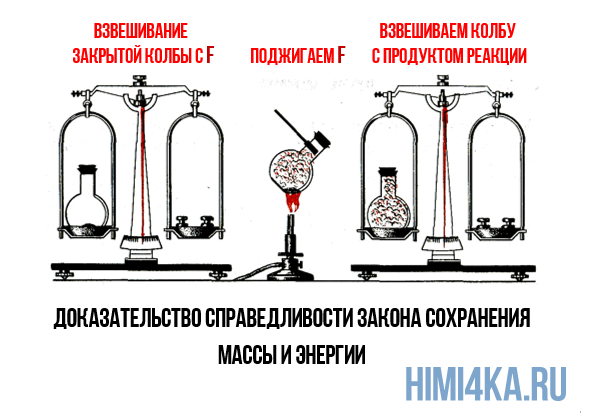
Кстати, в 1756 году Ломоносов экспериментально подтвердил химический закон сохранения массы, путем обжига металлов в запаянных сосудах. Вместо обжига металлов можно в запаянном сосуде сжечь фтор, закон сохранения массы все равно соблюдается:
Повторюсь, что не плотность или объем, а именно масса является фундаментальным свойством, сохраняющимся в процессе химических реакций. И как только химики это поняли, они сразу бросились в поиски правильной шкалы атомных масс для каждого элемента. В уроке 3 «Строение молекулы» мы отмечали, что молекулярная масса молекулы вычисляется через сумму всех атомных масс входящих в ее состав атомов. А из урока 5 «Моль и молярная масса» нам известно, что моль любого вещества — это такое его количество, в котором число частиц этого вещества равно 6,022·10 23 . Масса одного моля вещества в граммах называется молярной массой. Моль и молярная масса являются важнейшими понятиями, без которых невозможно проводить химический расчет.
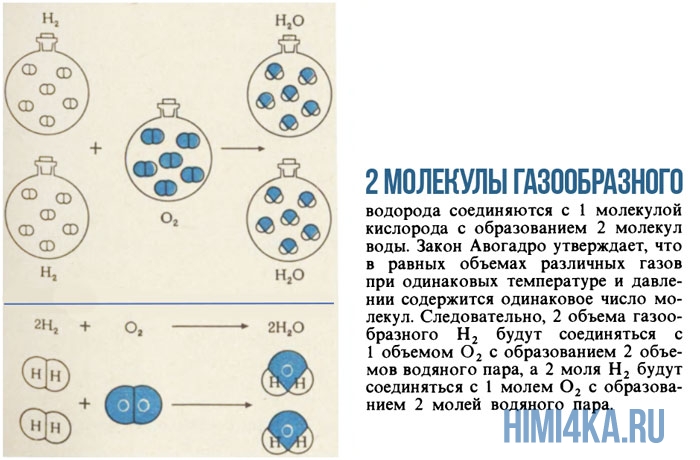
Моль — это просто средство подсчитывать атомы и молекулы порциями по 6,022·10 23 . Если известно, что две молекулы газообразного водорода H2 реагируют с одной молекулой газообразного кислорода O2, с образованием двух молекул воды H2O, то можно предсказать, что 2 моля H2, т.е. 4,032 г, будут реагировать с 1 молем O2, т.е. с 31,999 г, с образованием 2 молей H2O, т.е.36,031 г). Контрольное суммирование 4,032+31,999=36,031 подтверждают, что в этой реакции выполняется химический закон сохранения массы.
Урок 11 «Формулировка закона сохранения массы и энергии» является повторением уже пройденного материала перед погружением в более серьезный раздел химии. Надеюсь вы открыли в этом уроке для себя что-то новое и интересное. Если у вас возникли вопросы, пишите их в комментарии.
Урок №17-18. Закон сохранения массы веществ.
Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос наблюдайте за следующими видео-экспериментами:
Вывод: Масса веществ до и после реакции не изменилась.
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.
Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.
Химические уравнения
Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H 2 ; N 2 ; O 2 ; F 2 ; Cl 2 ; Br 2 ; I 2 . Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
В данном случае это атомы кислорода.
Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Урок по теме: «ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ. УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
«ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ.
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ»
Цели урока: сформировать представления о законе сохранения массы веществ, выработать умения применять его, объяснить сущность химических реакций и процесса составления уравнений химических реакций, формировать умения выявлять существенное, делать выводы, устанавливать межпредметные связи, развивать экспериментальные умения, формировать мировоззренческие понятия о познаваемости природы.
Планируемые результаты обучения
Предметные. Знать суть закона сохранения массы веществ, уметь его объяснять с точки зрения атомно-молекулярного учения.
Метапредметные. Развивать критическое мышление, умение устанавливать причинно-следственные связи, прогнозировать, делать выводы, планировать и регулировать свою учебную деятельность.
Личностные. Формировать ответственное отношение к учебной деятельности, познавательную и информационную культуру, умение сотрудничать с учителем, одноклассниками.
«Доводы, до которых человек додумался сам, обычно убеждают его больше, нежели те, которые пришли в голову другим»
Урок начинаем с повторения домашнего задания, актуализации знаний о физических и химических явлениях с помощью творческого домашнего задания и отрывков из произведений художественной литературы.
В качестве домашнего задания к данному уроку учащимся было предложено нарисовать физические и химические явления: фотосинтез, кипение чайника, ржавление гвоздя, горение костра, таяние мороженого, горение электролампочки, сгибание гвоздя, растворение сахара, движение маятника часов, приготовление яичницы, звонок с урока и т. д. По рисункам одноклассников учащиеся определяют, какое это явление.
Далее предлагаем учащимся прослушать отрывки из художественных произведений с целью выяснить, о каком явлении идет речь.
Люблю грозу в начале мая,
Когда весенний первый гром,
Как бы резвяся и играя,
Грохочет в небе голубом.
Ф. И. Тютчев.Весенняя гроза
Последняя туча рассеянной бури!
Одна ты несешься по ясной лазури,
Одна ты наводишь унылую тень,
Одна ты печалишь ликующий день.
А. С. Пушкин. Туча
Мой костер в тумане светит:
Искры гаснут на лету.
Я. П. Полонский. Песни цыганки
Шалун уж заморозил пальчик,
Ему и больно и смешно,
А мать грозит ему в окно.
А. С. Пушкин. Евгений Онегин
Являлся красный лев — и был он женихом,
И в теплой жидкости они его венчали
С прекрасной лилией, и грели их огнем,
И из сосуда их в сосуд перемещали.
Актуализацию знаний ключевых терминов, понятий проводим в форме устного опроса. Перечень проверяемых понятий: химическое явление, физическое явление, индекс, коэффициент, химическая формула, признаки химических реакций.
Затем переходим к изучению нового материала.
Этап постановки проблемы, цели урока (построение проекта проверки гипотезы).
Вопрос. В печи сожгли уголь массой 10кг, а масса образовавшейся золы составила всего 3кг. Почему?
Учитель. Изучая химические явления, вы узнали, что при их осуществлении одни вещества превращаются в другие. Вы высказали предположение, что в химических реакциях атомы переходят из одних веществ в другие. Следовательно, продукты реакции состоят из тех атомов, которые входили в состав реагентов.
Проблемный вопрос: Что вы можете сказать о массе реагентов и продуктов? Какие у вас предположения возникают?
Выдвигают гипотезы, прикрепляю их на доску.
Какие пути решения гипотезы вы предлагаете? Есть еще?
Чтобы ответить на данный вопрос понаблюдайте за следующими экспериментами
Этап открытия новых знаний (реализация проекта проверки гипотезы).
1. Взаимодействие мрамора с соляной кислотой, не закрывая пробкой
На весах уравновесьте сосуд Ландольта, в одном колене которого находится мрамор, а в другом — соляная кислота. Слейте растворы. Произошла химическая реакция.
2. Реакция между растворами сульфата меди (2) и гидроксида натрия
На весах уравновесьте сосуд Ландольта, в одном колене которого находится раствор сульфата меди (2), а в другом — гидроксид натрия. Слейте растворы. Произошла химическая реакция.
Изменилась ли масса веществ до и после реакции? Нарушилось ли равновесие весов?
Описание эксперимента: В коническую колбу помесите 2 грамма измельченной меди. Плотно закройте колбу пробкой и взвесьте. Запомните массу колбы. Осторожно нагревайте колбу в течение 5 минут и наблюдайте за происходящими изменениями. Прекратите нагревание, и когда колба охладится, взвесьте её. Сравните массу колбы до нагревания с массой колбы после нагревания.
Данный опыт является аналогом исторического эксперимента, проведенного несколькими учеными.
Вывод: Масса колбы после нагревания не изменилась.
Еще Леонардо да Винчи сказал: «Знания, не проверенные опытом, матерью всякой достоверности, бесплодны и полны ошибок». Значит, гипотеза никогда не станет законом, если ее не подтвердить экспериментально.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в ходе химических реакций изменяется.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается неизменной и что при прокаливании к металлу присоединяется воздух (кислород в то время не был еще открыт). Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде.
Таким образом, независимо друг от друга, М.В. Ломоносов и А. Лавуазье подтвердили справедливость предположения о сохранении массы веществ в результате химической реакции.
Это предположение стало законом лишь после десятилетнего исследования немецкого химика Г. Ландольта в начале 20 века.
М. В. Ломоносов впервые в истории науки сформулировал один из основных законов природы — закон сохранения материи. Он писал: «Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько присовокупится к другому. Сей всеобщий естественный закон простирается и в самые правила движения. ».
Как бы вы сформулировали этот закон?
Учащиеся записывают в тетрадях современную формулировку закона сохранения массы веществ, при химических реакциях.
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
Этап включения новых знаний в систему знаний.
Этот закон действует не только в химии, но и в физике. Докажите это, выполните задание 4.Используя закон сохранения массы веществ, объясните устно следующие явления:
А. В двух емкостях, одна из которых закрыта герметичной крышкой, в течение 2 минут кипит вода массой 4 кг. В какой из емкостей измениться масса воды? Почему?
Б. Пустую пластиковую бутылку в горячую воду. Что происходит с объемом и массой пустой бутылки? Почему?
А почему масса вещества сохраняется, что является причиной этому?
Вопрос о сущности химического превращения долгое время оставался загадкой для естествоиспытателей. Только с развитием атомно-молекулярной теории стало возможным предположить, как на уровне атомов и молекул происходят химические реакции.
Вещества состоят из молекул, а молекулы – из атомов. В ходе химической реакции атомы, входящие в состав исходных веществ, не исчезают и не появляются новые атомы.
Тогда, мы можем предположить, что в результате химической реакции продукты реакции образуются из атомов, которые ранее входили в состав исходных веществ. Вот модель химической реакции:
Проанализируйте данную модель, какую гипотезу вы можете выдвинуть?
Ответ: этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка, поэтому суммарная масса продуктов реакции остается равной суммарной массе исходных веществ
Закон сохранения массы веществ, применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия меди и кислорода получено вещество – оксид меди (II) – оно отличается от исходной смеси. По свойствам оно отличается от исходных веществ. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называютсяреагентами.
Новые вещества, образующиеся в результате химической реакции называютсяпродуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
2 Cu + O 2 = 2 CuO
За сегодняшний урок у меня добавились положительные эмоции от общения с вами, а у вас, надеюсь, новые впечатления. Поделитесь этими впечатлениями.
Продолжите мое предложение:
Мне на уроке понравилось…..
Захотелось больше узнать о……
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2 . Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
- Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
- Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен:
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он обнаружил, что масса веществ до и после реакции остается неизменной. Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он обнаружил, что масса веществ до и после реакции остается неизменной. Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он обнаружил, что масса веществ до и после реакции остается неизменной. Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов.
Более двух столетий прошло со дня смерти М.В.Ломоносова. Лучшие люди России всегда отдавали должное его заслугам.
“На берегах Ледовитого моря подобно северному сиянию, блеснул Ломоносов. Ослепительно и прекрасно было это явление! Оно доказало собой, что человек есть человек во всяком состоянии и во всяком климате, что гений умеет торжествовать над всеми препятствиями, какие ни противопоставляет ему враждебная судьба, что, наконец, русский способен ко всему великому и прекрасному не менее всякого европейца”. В.Г. Белинский .
Эпиграф к уроку:
Скажи, чем гордишься ты?
Ты плод ошибок и слез,
Силам потраченным счет.
Всюду: «Что нового?» — слышишь.
Да вдумайся в старое прежде!
В нем для себя найдешь ты нового много!
«Все изменяется, но ничто не исчезает»
http://www.sites.google.com/site/himulacom/%D0%B7%D0%B2%D0%BE%D0%BD%D0%BE%D0%BA-%D0%BD%D0%B0-%D1%83%D1%80%D0%BE%D0%BA/8-%D0%BA%D0%BB%D0%B0%D1%81%D1%81-%D0%BF%D0%B5%D1%80%D0%B2%D1%8B%D0%B9-%D0%B3%D0%BE%D0%B4-%D0%BE%D0%B1%D1%83%D1%87%D0%B5%D0%BD%D0%B8%D1%8F/%D1%83%D1%80%D0%BE%D0%BA-17-18-%D0%B7%D0%B0%D0%BA%D0%BE%D0%BD-%D1%81%D0%BE%D1%85%D1%80%D0%B0%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BC%D0%B0%D1%81%D1%81%D1%8B-%D0%B2%D0%B5%D1%89%D0%B5%D1%81%D1%82%D0%B2-%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F
http://infourok.ru/urok-po-teme-zakon-sohraneniya-massy-veshestv-uravneniya-himicheskih-reakcij-5811343.html