Теория электролитической диссоциации
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Что такое электролитическая диссоциация
Давно известно, что некоторые растворы проводят электрический ток (такие растворы получили название электролитов), а некоторые — не проводят (неэлектролиты).
Кроме электропроводности электролиты и неэлектролиты имеют много других отличий. При одинаковой молярной концентрации электролиты (по сравнению с неэлектролитами) обладают:
- более высокой температурой кипения;
- более низкой температурой замерзания;
- более высоким осмотическим давлением;
- более низким давлением пара растворителя.
Такое большое различие в свойствах растворов ученые объясняют тем фактом, что в электролитах при растворении образуется гораздо большее кол-во частиц, которые еще и обладают зарядом, хотя, в общем, раствор электролита нейтрален.
Впервые теорию электролитической диссоциации (разделения) сформулировал в 1887 г. шведский ученый С. Аррениус, ее основные положения заключались в следующем:
- электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
- под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы — к аноду (положительному электроду);
- электролитическая диссоциация является обратимым процессом — параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.
Через несколько лет, в 1891 г., русский ученый И. Каблуков внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом).
| Электролитической диссоциацией (ионизацией) называют процесс распада электролитов на ионы в водном растворе (расплаве) |
Ионами называют атомы (группы атомов), которые имеют заряд (положительный — анионы или отрицательный — катионы).
| Растворы электролитов нейтральны потому, что общая сумма зарядов анионов всегда равна общей сумме зарядов катионов |
Механизм электролитической диссоциации
Электролиты бывают двух видов: раствором с ионной связью и раствором с ковалентной связью.
Растворители, в которых протекает процесс диссоциации, обязательно состоят из полярных молекул.
Механизм диссоциации электролитов с ионной и ковалентной связью различен.
Диссоциация хлорида натрия
Хлорид натрия является веществом с ионной связью, в узлах кристаллической решетки NaCl находятся ионы натрия и хлора.
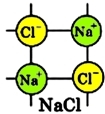
Рис. 1. Кристаллическая решетка хлорида натрия.
При погружении поваренной соли в воду на первой стадии растворения (диссоциации NaCl) полярные молекулы воды под действием электростатического притяжения приклеиваются своей отрицательной стороной к катионам натрия (Na + ), а положительной стороной к анионам хлора (Cl — ):
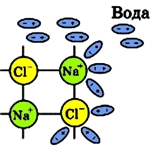
Рис. 2 Притяжение полярных молекул воды к ионам NaCl.
По мере склеивания молекул воды с ионами натрия и хлора происходит ослабление ионных связей Na + с Cl — :
Кристаллическая решетка постепенно разрушается, в результате чего, освободившиеся ионы переходят в раствор, в котором они тут же связываются с молекулами воды — такие ионы называются гидратированными.
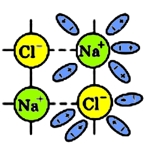
Рис. 3 Ослабление ионных связей хлорида натрия.
Ионные связи хлорида натрия разрываются и гидратированные ионы переходят в раствор:
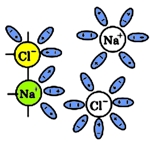
Рис. 4 Переход гидратированных ионов натрия и хлора в раствор.
В водном растворе диссоциация ионных соединений всегда протекает полностью.
Диссоциация хлороводорода
Хлороводород является веществом с ковалентной полярной связью.
Под воздействием молекул воды ковалентные связи поляризуются еще больше и становятся связями ионными, после чего происходит процесс, описанный выше:
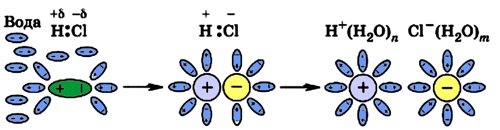
Рис. 5 Диссоциация полярной молекулы HCl.
Из вышесказанного можно сделать вывод, что электролитическая диссоциация возможна в полярных растворителях (вода, этиловый спирт). При диссоциации в первую очередь разрываются наиболее полярные связи (самая большая разность в электроотрицательности атомов, составляющих связь; см. Понятие электроотрицательности).
Растворитель выполняет не только роль разделения катионов и анионов растворяемого вещества, но также замедляет обратный процесс ассоциации ионов в исходную молекулу, поскольку сольватированные (гидратированные) ионы окружены «прилипшими» молекулами растворителя, что мешает сближению (под воздействием кулоновского электростатического притяжения) и воссоединению в молекулу катионов и анионов. Кол-во молекул растворителя, находящихся в гидратной оболочке ионов, зависит от природы ионов, концентрации и температуры раствора.
Одно из главных отличий диссоциации электролитов с полярной связью от диссоциации электролитов с ионной связью заключается в том, что такая диссоциация может быть частичной — это зависит от полярности связей в молекулах электролитов.
Уравнения электролитических диссоциаций записываются следующим образом:
Электролитическая диссоциация протекает за счет энергии, выделяемой в процессе разрушения кристаллической решетки растворяемого вещества во время взаимодейтсвия молекул растворителя с веществом. Следует сказать, что диссоциация может протекать и без растворителя, например, при высокой температуре, когда образуется расплав вещества (энергия для разрушения кристаллической решетки берется из внешнего источника высокой температуры).
ИТОГ : Электролитическая диссоциация — это процесс распада вещества (электролита) на ионы (в растворах под воздействием полярных молекул растворителя; в расплавах — под воздействием высокой температуры).
Свойства ионов
Атомы элементов и их ионы — это далеко не «родственники». По своим физическим и химическим свойствам ионы сильно отличаются от нейтральных атомов, из которых они образовались.
Такие сильные различия между атомами и их ионами объясняются разным электронным строением.
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
- пример диссоциации с образованием осадков:
- пример диссоциации с образованием газов:
- пример диссоциации с образованием слабых электролитов:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Записать уравнение электролитической диссоциации хлорида натрия
Вопрос по химии:
Запишите уравнения электролитической диссоциации веществ: а) хлорида натрия; б) фосфорной кислоты; в) хлорида алюминия, г) гидроксида бария.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://prosto-o-slognom.ru/chimia/04_dissotsiatsiya.html
http://online-otvet.ru/himia/5cea97d496f4e19a29475fb0



