Запишите уравнение электролитической диссоциации веществ : а) хлорида натрия ; б) нитрата калия ; в) хлорида алюминия?
Химия | 5 — 9 классы
Запишите уравнение электролитической диссоциации веществ : а) хлорида натрия ; б) нитрата калия ; в) хлорида алюминия.
Укажите названия всех ионов.
A) NaCl = Na + + Cl — , ион Na + и ион Cl — ;
б) KNO3 = K + + NO3 — .
Ион K + и ион NO3 — ;
в) AlCl3 = Al2 + + Cl — , ион Al2 + и ион Cl — .
Напишите уравнения электролитической диссоциации :1)хлорида алюминия2)фосфата калия3)азотной кислоты4)сульфата натрия5)хлорида магния?
Напишите уравнения электролитической диссоциации :
Составьте уравнения электролитической диссоциации сульфата натрия, хлорида цинка, фосфата калия?
Составьте уравнения электролитической диссоциации сульфата натрия, хлорида цинка, фосфата калия.
Нитрат калия и хлорид натрия — составить ионное уравнение?
Нитрат калия и хлорид натрия — составить ионное уравнение?
Напишите уравнение электрической диссоциации следующих веществ : гидроксид натрия, серной кислоты, нитрата калия, хлорид магния, сульфата алюминия?
Напишите уравнение электрической диссоциации следующих веществ : гидроксид натрия, серной кислоты, нитрата калия, хлорид магния, сульфата алюминия.
Написать уравнение электрический диссоциации хлорид алюминия, сульфат железа, гидросульфат калия, нитрат алюминия,?
Написать уравнение электрический диссоциации хлорид алюминия, сульфат железа, гидросульфат калия, нитрат алюминия,.
Запишите уравнения электролитической диссоциации веществ а)хлорида калия, б) гидроксида натрия, в) Нитрата магния?
Запишите уравнения электролитической диссоциации веществ а)хлорида калия, б) гидроксида натрия, в) Нитрата магния.
Укажите названия всех ионов.
Написать уравнения электролитической диссоциации веществ (если возможны) : хлорид магния, нитрат алюминия, сульфат бария, гидроксид цинка, фосфат лития, фосфат натрия, серная кислота, силикат калия, с?
Написать уравнения электролитической диссоциации веществ (если возможны) : хлорид магния, нитрат алюминия, сульфат бария, гидроксид цинка, фосфат лития, фосфат натрия, серная кислота, силикат калия, сульфат магния, фосфорная кислота, оксид серы (VI), вода, сульфид калия, бромид алюминия, хлорид серебра (I).
Вещество при растворении которого в воде электролитической диссоциации практически не происхолит 1)гидроксид натрия?
Вещество при растворении которого в воде электролитической диссоциации практически не происхолит 1)гидроксид натрия.
2)сульфат калия 3)хлорид серебра 4)нитрат алюминия.
Напишите уравнения электролитической диссоциации : а)Карбоната калия, б)сернистой кислоты, в)гидроксида натрия, г)нитрата серебра, д)хлорида железа(|||)?
Напишите уравнения электролитической диссоциации : а)Карбоната калия, б)сернистой кислоты, в)гидроксида натрия, г)нитрата серебра, д)хлорида железа(|||).
Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота?
Напишите уравнения электролитической диссоциации следующих веществ хлорида магния карбоната калия нитрат железа III гидроксид натрия азотная кислота.
Вы перешли к вопросу Запишите уравнение электролитической диссоциации веществ : а) хлорида натрия ; б) нитрата калия ; в) хлорида алюминия?. Он относится к категории Химия, для 5 — 9 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
Что такое электролитическая диссоциация
Давно известно, что некоторые растворы проводят электрический ток (такие растворы получили название электролитов), а некоторые — не проводят (неэлектролиты).
Кроме электропроводности электролиты и неэлектролиты имеют много других отличий. При одинаковой молярной концентрации электролиты (по сравнению с неэлектролитами) обладают:
- более высокой температурой кипения;
- более низкой температурой замерзания;
- более высоким осмотическим давлением;
- более низким давлением пара растворителя.
Такое большое различие в свойствах растворов ученые объясняют тем фактом, что в электролитах при растворении образуется гораздо большее кол-во частиц, которые еще и обладают зарядом, хотя, в общем, раствор электролита нейтрален.
Впервые теорию электролитической диссоциации (разделения) сформулировал в 1887 г. шведский ученый С. Аррениус, ее основные положения заключались в следующем:
- электролиты, растворяясь в воде, диссоциируют (распадаются) на положительно (катионы) и отрицательно (анионы) заряженные ионы;
- под воздействием внешнего электрического поля катионы в растворе электролита начнут двигаться к катоду (отрицательному электроду), анионы — к аноду (положительному электроду);
- электролитическая диссоциация является обратимым процессом — параллельно с распадом молекул на ионы идет обратный процесс ассоциации (ионы соединяются в молекулы), в результате чего в растворе устанавливается динамическое равновесие.
Через несколько лет, в 1891 г., русский ученый И. Каблуков внес существенные уточнения в теорию Аррениуса, введя понятие сольватации катионов и анионов (формирование химических связей между растворителем и растворяемым веществом).
| Электролитической диссоциацией (ионизацией) называют процесс распада электролитов на ионы в водном растворе (расплаве) |
Ионами называют атомы (группы атомов), которые имеют заряд (положительный — анионы или отрицательный — катионы).
| Растворы электролитов нейтральны потому, что общая сумма зарядов анионов всегда равна общей сумме зарядов катионов |
Механизм электролитической диссоциации
Электролиты бывают двух видов: раствором с ионной связью и раствором с ковалентной связью.
Растворители, в которых протекает процесс диссоциации, обязательно состоят из полярных молекул.
Механизм диссоциации электролитов с ионной и ковалентной связью различен.
Диссоциация хлорида натрия
Хлорид натрия является веществом с ионной связью, в узлах кристаллической решетки NaCl находятся ионы натрия и хлора.
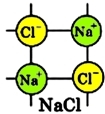
Рис. 1. Кристаллическая решетка хлорида натрия.
При погружении поваренной соли в воду на первой стадии растворения (диссоциации NaCl) полярные молекулы воды под действием электростатического притяжения приклеиваются своей отрицательной стороной к катионам натрия (Na + ), а положительной стороной к анионам хлора (Cl — ):
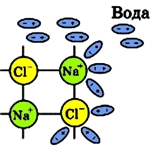
Рис. 2 Притяжение полярных молекул воды к ионам NaCl.
По мере склеивания молекул воды с ионами натрия и хлора происходит ослабление ионных связей Na + с Cl — :
Кристаллическая решетка постепенно разрушается, в результате чего, освободившиеся ионы переходят в раствор, в котором они тут же связываются с молекулами воды — такие ионы называются гидратированными.
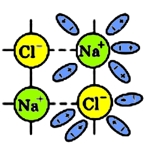
Рис. 3 Ослабление ионных связей хлорида натрия.
Ионные связи хлорида натрия разрываются и гидратированные ионы переходят в раствор:
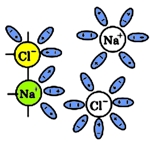
Рис. 4 Переход гидратированных ионов натрия и хлора в раствор.
В водном растворе диссоциация ионных соединений всегда протекает полностью.
Диссоциация хлороводорода
Хлороводород является веществом с ковалентной полярной связью.
Под воздействием молекул воды ковалентные связи поляризуются еще больше и становятся связями ионными, после чего происходит процесс, описанный выше:
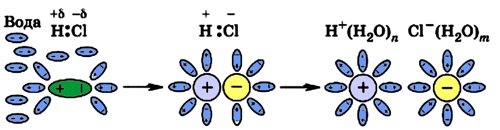
Рис. 5 Диссоциация полярной молекулы HCl.
Из вышесказанного можно сделать вывод, что электролитическая диссоциация возможна в полярных растворителях (вода, этиловый спирт). При диссоциации в первую очередь разрываются наиболее полярные связи (самая большая разность в электроотрицательности атомов, составляющих связь; см. Понятие электроотрицательности).
Растворитель выполняет не только роль разделения катионов и анионов растворяемого вещества, но также замедляет обратный процесс ассоциации ионов в исходную молекулу, поскольку сольватированные (гидратированные) ионы окружены «прилипшими» молекулами растворителя, что мешает сближению (под воздействием кулоновского электростатического притяжения) и воссоединению в молекулу катионов и анионов. Кол-во молекул растворителя, находящихся в гидратной оболочке ионов, зависит от природы ионов, концентрации и температуры раствора.
Одно из главных отличий диссоциации электролитов с полярной связью от диссоциации электролитов с ионной связью заключается в том, что такая диссоциация может быть частичной — это зависит от полярности связей в молекулах электролитов.
Уравнения электролитических диссоциаций записываются следующим образом:
Электролитическая диссоциация протекает за счет энергии, выделяемой в процессе разрушения кристаллической решетки растворяемого вещества во время взаимодейтсвия молекул растворителя с веществом. Следует сказать, что диссоциация может протекать и без растворителя, например, при высокой температуре, когда образуется расплав вещества (энергия для разрушения кристаллической решетки берется из внешнего источника высокой температуры).
ИТОГ : Электролитическая диссоциация — это процесс распада вещества (электролита) на ионы (в растворах под воздействием полярных молекул растворителя; в расплавах — под воздействием высокой температуры).
Свойства ионов
Атомы элементов и их ионы — это далеко не «родственники». По своим физическим и химическим свойствам ионы сильно отличаются от нейтральных атомов, из которых они образовались.
Такие сильные различия между атомами и их ионами объясняются разным электронным строением.
При наличии в растворе нескольких электролитов они диссоциируют в сторону образования: 1) осадков; 2) газов; 3) слабых электролитов.
- пример диссоциации с образованием осадков:
- пример диссоциации с образованием газов:
- пример диссоциации с образованием слабых электролитов:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Запишите уравнение диссоциации хлорида натрия
Вопрос по химии:
Запишите уравнения электролитической диссоциации веществ: а) хлорида натрия; б) фосфорной кислоты; в) хлорида алюминия, г) гидроксида бария.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
http://prosto-o-slognom.ru/chimia/04_dissotsiatsiya.html
http://online-otvet.ru/himia/5cea97d496f4e19a29475fb0







