Горение углерода
Химический механизм горения углерода в достаточной мере еще не раскрыт. Однако в последнее время установлено, что в результате реагирования углерода с кислородом одновременно образуются оба окисла углерода СО и СО2, но в разных соотношениях. При t = 1200 °С образуются оба окисла и в одинаковом количестве. При t= 1600 °С СО образуется вдвое больше, чем С02.
Горение твердого углерода является гетерогенной реакцией, происходящей на поверхности.
Прямая реакция горения углерода:
С + О2 —^ СО2 (основная), но протекают и побочные реакции:
С + С02 —» 2СО (экзотермические реакции);
2СО +02 2С02 (экзотерм.);
2С + 02 -> 2СО (экзотерм.).
Кроме того, в присутствии водяных паров на раскаленной поверхности углерода происходит газификация твердого углерода по реакции
С + Н20 —» СО + Н2 (высокотемпературная область);
С +2Н20 —» С02 + 2Н2 (низкотемпературная область).
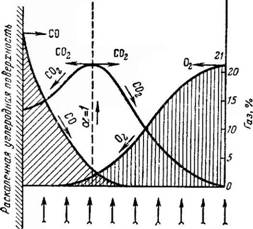
Так как реакция горения углерода является гетерогенной, то скорость ее протекания зависит от организации подвода кислорода к поверхности углерода и скорости химической реакции. Подвод О2 осуществляется за счет турбулентной и молекулярной диффузии. Происходящие побочные реакции (образование СО за счет восстановления СО2 и догорания СО в СО2) оказывают влияние на итоговую скорость горения углерода. Наиболее вероятна такая схема: на поверхности углерода образуется СО2, затем С + СО2 —» 2СО; далее в зоне с большим содержанием кислорода 2СО +О2 —» 2СО2.
Интенсификация процесса горения может быть осуществлена улучшением газообмена у поверхности углерода (рис. 5.2).
5.3.5. Диффузная и кинетическая области гетерогенного горения
При низких температурах скорость химического взаимодействия горючего и окислителя мала. Она намного меньше скорости их взаимной диффузии, которая поэтому почти не влияет на ход процесса. Считается, что процесс горения протекает в кинетической области и его следует рассматривать как чисто химический процесс.
Область Область избытка
недостатка боздиха (се >/>
Поток бозйуха, омывающий углеродную поверхность
Рис. 5.2. Изменение концентрации газов у поверхности частицы горящего углерода
При высоких температурах или ухудшенных условиях массообмена скорость реакции намного опережает скорость диффузии, которая в данном случае определяет ход процесса. Можно считать, что процесс горения развивается в диффузной области и его следует рассматривать с чисто физической сторо-
Наиболее подробно исследования горения углерода сделаны советскими учеными — школой чл.-корр. АН СССР А. С. Предводителева Дальнейшее развитие исследования гетерогенных процессов в натуральном топливе проводил Г. Ф. Кнорре.
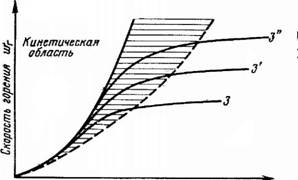
В начальный период реакции, когда температура низка, скорость реакции незначительна, а концентрация кислорода у поверхности горящей частицы топлива велика. При этом скорость горения лимитируется скоростью протекания химической реакции окисления, т. е. кинетикой горения. Горение проходит в кинетической области (рис. 5.3).
Промежуточная Дшррузиопная, область область
Рис. 5.3. Изменение скорости химической реакции в зависимости от температуры
По мере расходования кислорода его концентрация у поверхности частицы уменьшается. Одновременно с этим возрастает температура, а вместе с ней и скорость химической реакции. Кислорода начинает не хватать. Скорость горения начинает лимитироваться скоростью диффузии кислорода. Так горение переходит в диффузную область. В диффузной области скорость горения не зависит от температуры. Между этими областями находится промежуточная переходная область, где влияние кинетики и диффузии соизмеримы. При увеличении интенсивности газообмена у поверхности горящей частицы кривая сдвигается в область больших скоростей химической реакции.
Реакция взаимодействия углерода и кислорода
Реакция взаимодействия углерода и кислорода
Уравнение реакции взаимодействия углерода и кислорода:
Реакция взаимодействия углерода и кислорода.
В результате реакции образуется оксид углерода (IV).
Реакция протекает при условии: при температуре 600-700 °C.
Частным случаем данной реакции является сжигание кокса на воздухе.
Термохимическое уравнение реакции взаимодействия углерода и кислорода:
Формула поиска по сайту: C + O2 → CO2.
Реакция взаимодействия алюминия и паров воды
Реакция взаимодействия кальция и азотной кислоты
Реакция взаимодействия оксида кремния (IV), углерода и оксида кальция
Выбрать язык
Популярные записи
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Напишите уравнения реакций горения в кислороде: а) серы; б) алюминия; в) метана (углерод в образующемся оксиде четырехвалентен). Назовите продукты реакций
Ваш ответ
решение вопроса
Похожие вопросы
- Все категории
- экономические 43,298
- гуманитарные 33,622
- юридические 17,900
- школьный раздел 607,232
- разное 16,830
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
http://chemicalstudy.ru/reaktsiya-vzaimodejstviya-ugleroda-i-kisloroda/
http://www.soloby.ru/295034/%D0%BD%D0%B0%D0%BF%D0%B8%D1%88%D0%B8%D1%82%D0%B5-%D1%83%D1%80%D0%B0%D0%B2%D0%BD%D0%B5%D0%BD%D0%B8%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4%D0%B5-%D0%BE%D0%B1%D1%80%D0%B0%D0%B7%D1%83%D1%8E%D1%89%D0%B5%D0%BC%D1%81%D1%8F-%D1%87%D0%B5%D1%82%D1%8B%D1%80%D0%B5%D1%85%D0%B2%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%B5%D0%BD