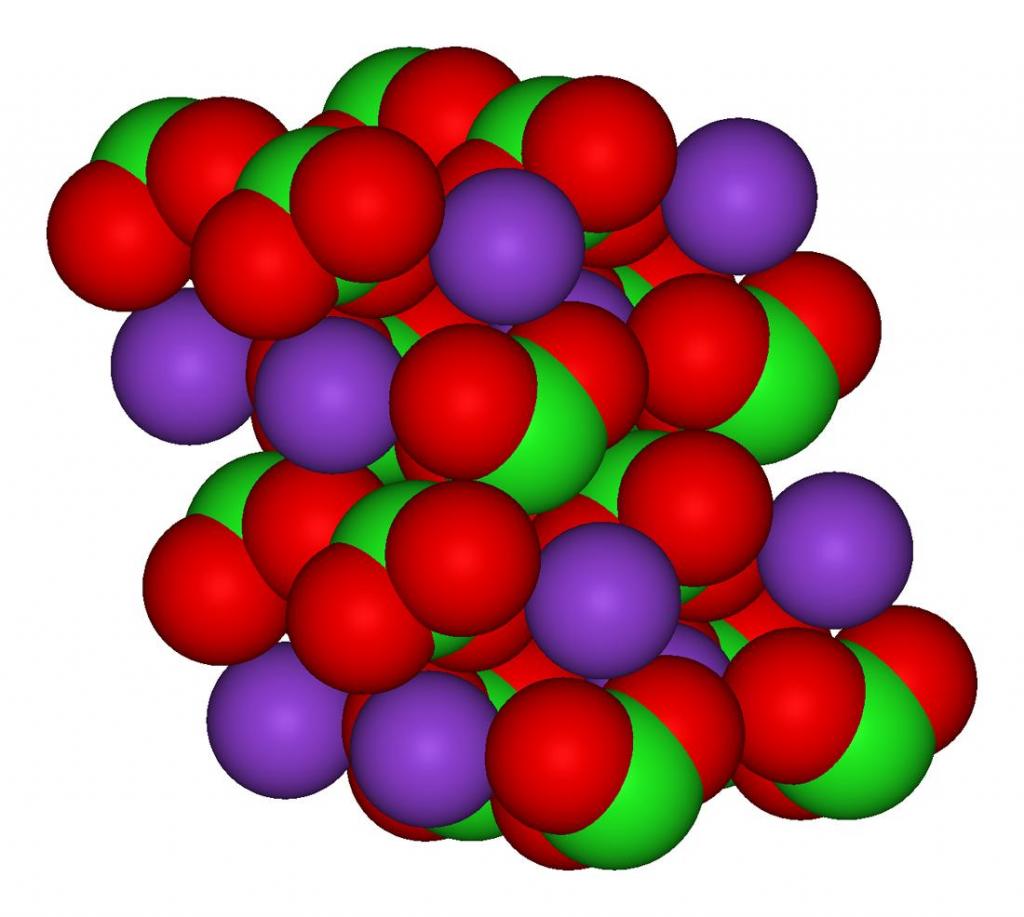
Хлорат калия
| Хлорат калия | |
|---|---|
 | |
 | |
| Систематическое наименование | Хлорат калия |
| Традиционные названия | Бертолетова соль |
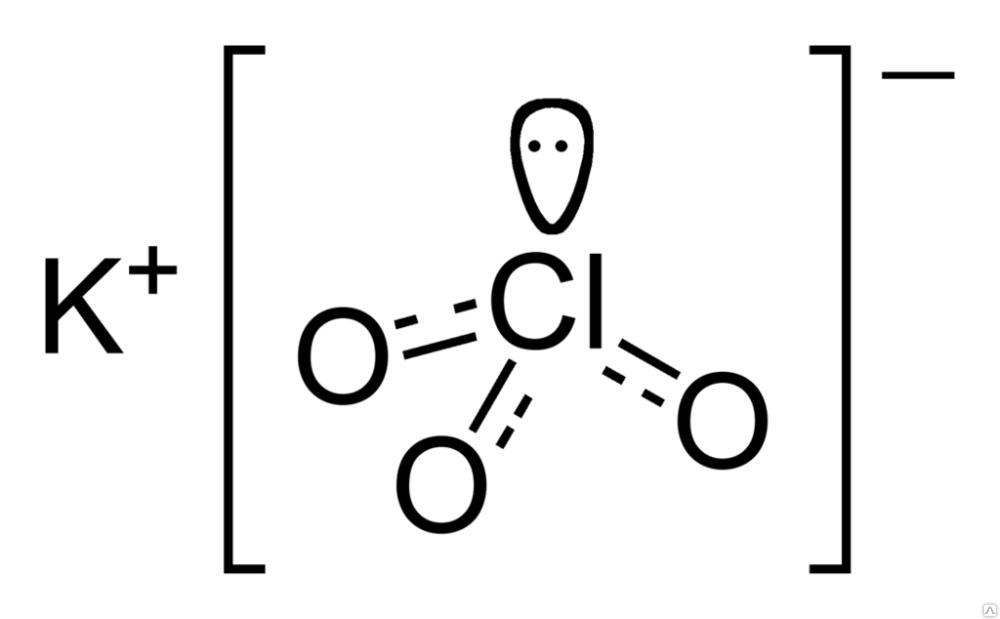
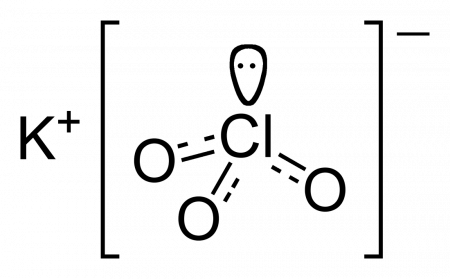
| Хим. формула | KClO3 |
| Состояние | Бесцветные кристаллы |
| Молярная масса | 122.55 г/моль |
| Плотность | 2,32 г/см³ |
| Температура | |
| • плавления | 356 °C |
| • разложения | |
| Энтальпия | |
| • образования | -391,204 кДж/моль |
| Растворимость | |
| • в воде при 0°C | 3,25 г/100 мл |
| • в воде при 20°C | 7,3 г/100 мл |
| • в воде при 100°C | 56,2 г/100 мл |
| • в воде при 104,2°C | 61,5 г/100 мл |
| Рег. номер CAS | [3811-04-9] |
| PubChem | 6426889 |
| Рег. номер EINECS | 223-289-7 |
| SMILES | |
| RTECS | FO0350000 |
| Номер ООН | 1485 |
| ChemSpider | 18512 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Хлорат калия (бертолетова соль, калий хлорноватокислый) — калиевая соль хлорноватой кислоты.
Содержание
- 1 История
- 2 Получение
- 3 Химические свойства
- 4 Применение
- 4.1 Взрывчатые вещества
- 4.2 В медицине
- 4.3 Для получения кислорода
- 4.4 Для получения диоксида хлора
- 5 Токсичность
История
Впервые получен Клодом Бертолле (отсюда название бертолетова либо бертоллетова соль) в 1786 году при пропускании хлора через горячий концентрированный раствор гидроксида калия:
6KOH + 3Cl2 → KClO3 + 5KCl + 3H2O
Получение
Промышленное получение хлоратов вообще (и хлората калия в частности) основано на реакции диспропорционирования гипохлоритов, в свою очередь получаемых взаимодействием хлора с растворами щелочей:
Cl2 + 2OH − → ClO − + Cl − + H2O 3ClO − → ClO3 − + 2Cl −
Технологическое оформление процесса может быть различно: поскольку наиболее многотоннажным продуктом является гипохлорит кальция (входящий в состав хлорной извести), то наиболее распространённым процессом является проведение реакции обмена между хлоратом кальция (получающимся из гипохлорита кальция при нагреве) и хлоридом калия, который, в силу относительно низкой растворимости, кристаллизуется из маточного раствора.
Также хлорат калия получают модифицированным методом Бертолле при бездиафрагменном электролизе хлорида калия, образующийся при электролизе хлор вступает во взаимодействие in situ (в момент выделения, «на месте») с гидроксидом калия с образованием гипохлорита калия, который далее диспропорционирует на хлорат калия и исходный хлорид калия. При использовании графитовых анодов более удобным методом является электролиз хлорида натрия с получением хлората натрия и обменная реакция с хлоридом калия. Это позволяет очищать от анодного шлама раствор хлората натрия, который имеет значительно большую растворимость, чем хлорат калия, и, таким образом, удобнее для фильтрации.
Химические свойства
- При температуре
400 °C разлагается с выделением кислорода с промежуточным образованием перхлората калия:
4KClO3 → 400oC 3KClO4 + KCl KClO4 → 550−620oC KCl + 2O2
- В присутствии катализаторов (MnO2, Fe2O3, CuO и др.) температура разложения значительно снижается (до
200 °C).
2KClO3 → 150−300 2KCl + 3O2
- Реагирует с сульфатом аммония в водно-спиртовом растворе c образованием хлората аммония:
(NH4)2SO4 + 2 KClO3 → 2NH4ClO3 + K2SO4
Применение
Взрывчатые вещества
Смеси хлората калия с восстановителями (фосфором, серой, алюминием, органическими соединениями) взрывчаты и чувствительны к трению и ударам, чувствительность повышается в присутствии броматов и солей аммония.
Из-за высокой чувствительности составов с бертолетовой солью, они практически не применяются для производства промышленных и военных взрывчатых веществ.
Иногда используется в пиротехнике как источник хлора для цветнопламенных составов, входит в состав горючего вещества спичечной головки, и крайне редко в качестве инициирующих взрывчатых веществ (хлоратный порох — «сосис», детонирующий шнур, тёрочный состав ручных гранат вермахта).
В медицине
Некоторое время растворы хлората калия применялись в качестве слабого антисептика, наружного лекарственного средства для полоскания горла.
Для получения кислорода
В начале XX века использовалась для лабораторного получения кислорода, но из-за малой доступности его перестали применять.
Для получения диоксида хлора
Реакция восстановления хлората калия щавелевой кислотой при добавлении серной кислоты используется для получения диоксида хлора в лабораторных условиях:
Хлорат калия может реагировать со щавелевой кислотой без присутствия серной кислоты, но эта реакция не применяется для препаративного получения диоксида хлора:
Токсичность
Токсичен. Смертельная доза хлората калия составляет 1 г/кг.
Хлорат калия: описание, формула, свойства
Калиевая соль хлорноватой кислоты, или хлорат калия, представляет собой неорганическое соединение, обладающее взрывчатыми свойствами. Высокая чувствительность к трению и реакционная способность ограничивают область его применения в промышленности.
Общее описание
Хлорат калия – твердое вещество в виде кристаллического мелкого порошка белого цвета, не имеющего запаха. Кристаллы обладают пластинчатой, игольчатой или призматической формой. Другое название этого соединения – бертолетова соль. Оно присвоено по имени французского химика Клода Луи Бертолле. Этот ученый впервые синтезировал данное вещество в 1786 году с помощью пропускания хлора через раствор калиевого щелока. Тогда же были открыты и его взрывчатые свойства.
Эмпирическая формула хлората калия имеет вид: ClKO₃.
Структурно вещество представлено на рисунке ниже. Три атома кислорода связаны с атомом хлора посредством ковалентной связи, а взаимодействие атома калия и хлора носит ионный характер.
По химическому составу компоненты распределяются таким образом:
- К – 31,92 %;
- Cl – 28,92 %;
- О – 39,16 %.
Химические свойства
Хлорат калия является сильным окислителем. Это свойство использовалось для получения пороха. Данное соединение может «поджечь» многие вещества, поэтому при работе с ним требуется аккуратность.
Данное соединение характеризуется следующими основными химическими свойствами:
- При нагреве до 400 °С происходит его разложение с выделением кислорода и образованием перхлората калия.
- При дальнейшем нагреве происходит выделение О2 и KCl.
- В реакции с сернокислым аммонием в водно-спиртовом растворе наблюдается образование высокобризантного (имеющего большую способность к разрушению) и чувствительного вещества – хлората аммония (NH₄ClO₃).
Интересной особенностью является то, что разложение хлората калия протекает с выделением теплоты, а перхлората – с поглощением ее. У перхлоратов также выше температура воспламенения. Данный факт является преимуществом в обращении с ClKO₄.
Физические свойства
Если в порошке присутствуют примеси Mn, CuO, Fe2O3 Cr2O3 и другие оксиды, то температура разложения сильно снижается (до 200 °C).
Основные физические свойства хлората калия перечислены ниже:
- температура плавления – 356 °C;
- температура кипения – 400 °C;
- гравиметрическая плотность – 2100-2250 кг/м³;
- кристаллическая плотность – 2340 кг/м³;
- молярная масса – 122,594 г/моль;
- растворимость в воде – хорошая (69,9 г /л при температуре 20 °C).
Получение
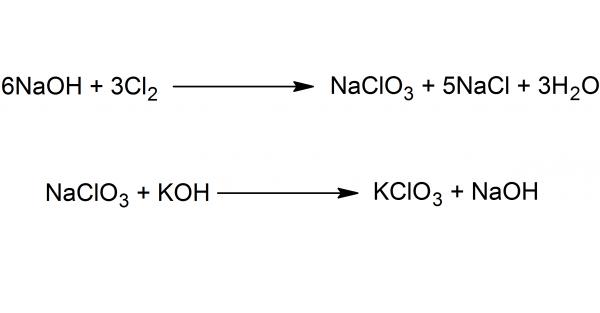
В химической промышленности синтез хлората калия производится при помощи дисмутации солей хлорноватистой кислоты HClO (реакция самоокисления-самовосстановления). Наиболее распространенным способом является обмен между Ca(ClO₃)₂ и KCl.
На рисунке ниже представлена схема получения вещества в два этапа — пропусканием хлора через раствор едкого натра с последующей обменной реакцией между хлоратом натрия и каустическим поташем.
Существуют и другие методы – термическое разложение гипохлорита калия, электрохимический метод (электролиз водных растворов хлоридов).
Влияние на живые организмы
Хлорат калия является токсичным веществом. Отравление этим соединением приводит к появлению следующих симптомов:
- при попадании в ЖКТ: боль в эпигастрии, тошнота, рвота;
- при поражении глаз или кожи: раздражение, покраснение;
- при попадании в органы дыхания: кашель, болезненные ощущения, затрудненное дыхание.
Смертельная доза – 1г/кг. Вещество токсично для флоры и фауны природных водоемов.
В качестве первой помощи пострадавшему необходимо предпринять следующие меры:
- вывести на свежий воздух;
- промыть кожу (глаза) чистой водой;
- прополоскать рот водой;
- снять загрязненную одежду.
Меры безопасности
При хранении вещество необходимо беречь от источников тепла и открытого огня. В помещении нельзя курить. Не допускается смешивать соединение с горючими материалами, так как это может привести к взрыву.
При воспламенении хлората калия огонь тушат песком, углекислотой в порошковых огнетушителях. Если произошло возгорание большого количества вещества, то необходимо покинуть опасную зону.
Изготовление взрывчатых веществ
В конце XIX – начале XX века хлорат калия использовался в качестве взрывчатого вещества. На его основе изготавливался так называемый «порох Бертолле», состав которого включал 75 % бертолетовой соли и по 12,5 % серы и угля. В отличие от обычного черного пороха, сделанного из калиевой селитры, данная химическая композиция имеет очень высокую чувствительность к механическому воздействию. От трения или удара порох Бертолле может загореться или взорваться. И хотя по мощности он превосходил все известные виды взрывчатых веществ в то время, химическая неустойчивость предопределила его ограниченное применение. В Швейцарии для повышения безопасности взрывчатых веществ, используемых при строительстве шахт, хлоратные соединения желатинировали.
Во время Первой мировой войны хлорат калия использовался в составе других видов взрывчатых веществ. Так, в Германии успешно применялась «силезия» (80 % ClKO₃ и 20 % смолы, обработанной азотной кислотой). В Австрии такие составы включали ClKO₃ и антраценовое масло. Постепенно хлорат калия, как составной элемент взрывчатых смесей, был вытеснен хлоратом натрия. В 1941-1945 гг. данное соединение входило в терочный состав немецких ручных гранат.
Другие области применения
В настоящее время хлорат калия иногда используется в качестве источника хлора в пиротехнических составах для получения цветного огня. Благодаря ему фейерверк горит интенсивнее и не ослабевает под давлением воздуха. Поэтому данное соединение применяют для ракет-форсов.
Бертолетова соль имеется также в составе спичечных головок. Если соскоблить вещество, собрать его в виде горки на твердом основании и стукнуть молотком, то можно наблюдать явление микровзрыва. Этот пример наглядно иллюстрирует исключительную чувствительность и опасность использования хлората калия.
Данное вещество применялось также некоторое время в качестве антисептического средства для полоскания рта и горла. После того, как были выявлены его токсические свойства, его перестали использовать в медицинских целях.
Запишите уравнение реакции хлората калия
Для выполнения задания используйте следующий перечень веществ: хлорат калия, нитрат лития, фосфат натрия, соляная кислота, азот. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна окислительно восстановительная реакция, и запишите уравнение этой реакции. Составьте электронный баланс, укажите окислитель и восстановитель.
Для выполнения задания используйте следующий перечень веществ: хлорат калия, нитрат лития, фосфат натрия, соляная кислота, азот. Допустимо использование водных растворов веществ.
Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Запишем уравнение реакции:
Составим электронный баланс:
Хлор в степени окисления −1 является восстановителем. Хлор в степени окисления +5 — окислителем.
| Критерии оценивания выполнения задания | Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: — выбраны вещества, и записано уравнение окислительно-восстановительной реакции; источники: http://www.syl.ru/article/467205/hlorat-kaliya-opisanie-formula-svoystva http://chem-ege.sdamgia.ru/problem?id=10220 |