Плавиковая кислота. Свойства и применение плавиковой кислоты
Плавиковая кислота и флюорит. Где взаимосвязь? На этот вопрос ответили шведский химик Карл Шееле и англичанин Джозеф Пристли. В 1779 году они доказали, что флюорит, называемый в народе плавиковым шпатом, является кальциевой солью неизвестной кислоты.
Сам камень был известен еще Георгию Агриколе – отцу минералогии, жившему в 15 веке. Он- то и нарек его флюоритом, от латинского fluor – «течь».
Имя объясняется применением породы в качестве флюса. Его добавка к шихте снижает температуру ее плавления. Так древние решали проблему обработки металлов. А где пригодилась названая по аналогии с камнем кислота, и чем, собственно, она является?
Что такое плавиковая кислота
Формула плавикового шпата – CaF2. В кислоту переходит лишь фтор, соединяясь с водородом. Получается фтороводород. То есть, у плавиковой кислоты формула HF. Промышленниками, как правило, используется раствор. Но, соединение может быть и безводным.
Такую форму впервые получили Гей Люссак и Жозеф Луи. Это французские химик и физик. Безводную плавиковую кислоту они представили миру в 1810 году.
Когда-то, растворы плавиковой кислоты стали двойным открытием. Фтор, находящийся в составе соединения, был не известен ученым.
Работая с кислотой, они поняли, что по активности вещество подобно хлору. Название нового элемента «фтор» закрепилось лишь в России, переводится с греческого, как «разрушающий». В остальном мире элемент именуют флюором.
Внешне фтороводород можно определить лишь по туману, который газообразное соединение образует с влажным воздухом. Выдает безводную кислоту и запах. У фтора он сильный и резкий. В остальном, фтороводород неуловим, поскольку бесцветен, смешивается с атмосферой.
Водный раствор фтороводорода тоже бесцветен, по консистенции жидкий. Плотность плавиковой кислоты равна 1,2 грамма на кубический сантиметр.
Показатель воды меньше лишь на 0,1 грамма на кубический сантиметр. Поэтому, есть риск перепутать соединение с чистой водой. Последствия могут быть катастрофическими. Плавиковая кислота – опасность для человека. Почему? Об этом поговорим в следующей главе.
Свойства плавиковой кислоты
Фтороводород считается самой сильной из кислот, уступая в реакционности лишь царской водке. Последняя, является смесью реактивов. В царской водке соединились сильные азотная и соляная кислоты.
Сила плавиковой кислоты демонстрируется в воздействии на стекло. Это инертный материал, не подвластный другим кислотам. Плавиковая же стекло плавит. Это заметил еще Шванквард — немецкий химик, живший в 17 столетии. Проводя опыты, он использовал сосуд из флюорита.
Налив в него однажды серную кислоту, он заметил, что стеклянная крышка начала плавиться. Реагент в сосуде не мог произвести такое действие.
Значит, в серной кислоте частично растворился плавиковый шпат, и что-то из его состава стало разъедать крышку. Этот вывод Шванкварда, собственно, и стал причиной поиска новой кислоты. Если растворившись в соляной кислоте соль плавиковой кислоты разъела стекло, что мешает ей разъесть органику?
Ничего. Попадая на кожу и слизистые, реагент разрушает их. Итогом становятся ожоги. Более того, реагент и его пары запускают мутагенные процессы в крови.
Выявлен слабый наркотический эффект. Все вкупе дает 2 класс опасности. Он присвоен кислоте официально. Попадая на кожу, фтор водород не вызывает мгновенной боли. Соединение незаметно всасывается клетками.
Отек начинается примерно через 5-10 минут. Одновременно приходит боль, химический ожог. Если контакт связан со слабым раствором реагента, симптомы могут проявиться, лишь через сутки.
Антидота, то есть, противоядия, нет. Получив смертельную дозу фтороводорода, надежды на спасение нет. Продержаться получается лишь несколько дней, и то на наркотиках. Разъедая стекло, прочие силикатные материалы, органику, плавиковая кислота не вступает во взаимодействие с пластиком.
Именно в нем реагент и транспортируют. Не взаимодействует с фтороводородом и парафин. Можно ли заменить тару из него или полиэтилена металлической? Зачастую, нет. Фтороводород вступает в реакцию с большинством металлов.
Среди немногих исключений – свинец. Но, он слишком тяжел и дорогостоящ, чтобы быть альтернативой пластику. Остается узнать, куда везут плавиковую кислоту, где она пригождается, если столь опасна.
Применение плавиковой кислоты
Плавиковая кислота применение, естественно, находит в стекольной промышленности. Реагент используют для химической полировки изделий и освобождения металлических деталей от примесей кварца и керамики.
Поскольку кремний плавиковая кислота плавит, обрабатывать можно и хрусталь, убирая с его поверхности все шероховатости. В качестве протравливающего вещества реагент используют, так же, в зуботехнической отрасли. Плавиковая кислота в стоматологии убирает с внутренней стороны керамических протезов лейцит.
Это породообразующий минерал магматического происхождения. Он – часть металлической подложки под слоем керамики. Цель – обеспечить максимально надежное крепление коронки к остаткам зуба. Лучше стандартного цемента с этой задачей справляются полимеры – новое слово в стоматологии.
Полимеры заполняют пустоты, оставшиеся от лейцита. Таким образом, живые ткани и протез скрепляются, как говориться, намертво. При этом, полимеры оставляют возможность минимальных подвижек, без растрескивания, а значит, и разгерметизации коронок.
Однако, основным потребителем фтороводорода остается нефтехимическая промышленность. В ней плавиковая кислота, так же, нужна для обработки, очистки поверхностей. В частности, соединение пригождается в призабойных зонах добывающих скважин.
В нагнетательных реагент тоже используют. В сочетании с другими кислотами, к примеру, соляной, плавиковая кислота удаляет со стенок аппаратуры отложения асфальтов и парафинов. Это повышает эффективность нефтедобычи.
Кислота фтористоводородная плавиковая применяется и в алюминиевой промышленности. Реагент непосредственно участвует в электролитическом способе получения 13 металла.
Кислота присутствует в фильтровочных системах. Теперь выясним, где найти реагент в природе. Является ли флюорит единственным источником фтороводорода?
Добыча плавиковой кислоты
Плавиковый шпат – источник для получения фтороводорода, но не он сам. В чистом виде кислоту в природе не встретишь, если, конечно, не подойдешь к активному вулкану. В его газах фтороводород встречается. Благо, флюорит – распространенный минерал. Промышленники не испытывают дефицита в сырье.
Получение плавиковой кислоты из шпата основано на его обработке серной кислотой. Требуется концентрированный реагент, 90 или 92-процентный. В общем, производят кислоту, как и 300 лет назад, по методу Шванкварда. Взаимодействие выглядит так: — CaF2 + H2SO4 -à2HF + CaSO4.
Для взаимодействия нужен измельченный флюорит. Минерал обрабатывают в щековых и конических дробилках.
С серной кислотой крошку соединяют в специальных смесителях. Реакция запускается почти моментально. Образующийся оксид кальция ведет к затвердению массы. Поэтому, продолжительность ее пребывания в смесителе должна быть минимальной.
Реакция протекает при температуре от 220 до 280 градусов Цельсия. Если снизить жар, образуется фторсульфоновая кислота.
Избавление от нее осложняет производство. Мешает ему и образование сульфата кальция. Он обволакивает частицы измельченного шпата, не давая реакции проходить эффективно.
Цена плавиковой кислоты
Цена реагента зависит от его чистоты и концентрации. Обычно выпускаются 40, 60 и 70-процентные растворы фтороводорода. С точки зрения чистоты кислота делится на техническую и обычную. 70 процентный раствор последний, к примеру, стоит в районе 210-250 рублей за килограмм.
Техническая версия реагента, обычно, 40-процентная. За килограмм дают 35-60 рублей. Поставки от одного кило осуществляют не все. Большинство производителей работают только с оптовиками.
В этом случае, ценник уменьшается. Купить плавиковую кислоту 70% можно и за 170 рублей за кило. Кроме стандартных, встречаются предложения, к примеру, 85-процентной кислоты. Такую поставляют, в основном, из Китая.
Некоторые предприятия России тоже готовы отработать нестандартные заказы при больших объемах закупок.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Химимческие и физические свойства фтороводорода и фторидов металловЗадача 819. В растворе плавиковой кислоты выделения фторида кремния не происходит, так как он взаимодействует с молекулами HF c образованием хорошо растворимой комплексной кремнефтороводородной кислоты: или уравнение реакции в общем виде: Ввиду того, что Фтороводород разрушает стекло, поэтому в лаборатории его хранят в сосудах из свинца или стеклянных сосудах, покрытых изнутри слоем парафина, а также в сосудах из специальных сортов пластмасс. Задача 820. NaF ↔ Na + + F — ; или в молекулярной форме: NaF + H2O ↔ F + NaOH В результате гидролиза в растворе появляется некоторый избыток ионов ОН-, которые придают раствору щелочную реакцию, рН > 7. б) Фторид натрия NH4F – соль слабого основания (NH4OH) и слабой кислоты (HF) гидролизуется как по катиону, так и по аниону: NH4F ↔ NH4 + + F — ; или в молекулярной форме: NaF + H2O ↔ HF + NaOH В процессе гидролиза NH4F в растворе образуются слабые электролиты (NH4OH и HF), а также ионы Н + и ионы ОН — , которые соединяясь образуют воду Так как KD(NH4OH) = 1,79 . 10 -8 . 10 -4 , то гидролиз катиона NH4 + будет преобладать над гидролизом аниона F — , значит, в растворе соли будет наблюдаться некоторый избыток ионов водорода Н + , что придаст раствору слабокислотную среду, (рН > 7 или рН = 7). в) Фторид кремния SiF4 в водных растворах подвергается гидролизу, в результате которого образуется фтористоводородная кислота (НF) и кремниевая кислота (H2SiO3): Образующийся фтороводород взаимодействует SiF4. При этом получается гексафторкремниевая (или кремнефтористоводородная) кислота: Суммарный процесс можно выразить уравнением: В результате гидролиза фторида кремния образуются кислоты, поэтому реакция раствора будет кислой, рН Задача 821. Электронные уравнения полуреакций: Zn 0 + 2H + ↔ Zn 2+ + H2O; К реакциям, в которых галогеноводороды играют роль окислителя, относятся реакции термической диссоциации: Задача 822. б) В бромате калия KBrO3 степень окисления брома равна +5, поэтому он будет играть роль окислителя. Значит, электродный потенциал галогена, который вытеснит бром из бромата калия, должен быть меньше. Так как электродные потенциалы системы Г2 + 10 источники: http://acetyl.ru/o/nh11f11.php http://buzani.ru/zadachi/khimiya-glinka/1270-ftoridy-ftorovodorod-zadachi-819-822 |





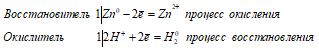
 = 2Br — равен 1,07 В (
= 2Br — равен 1,07 В (  0 (Red.) ).
0 (Red.) ).