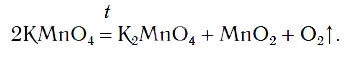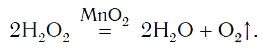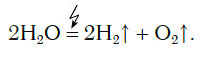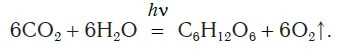Урок 17. Получение кислорода
В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
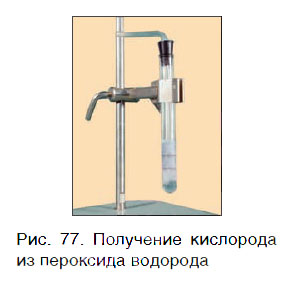
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
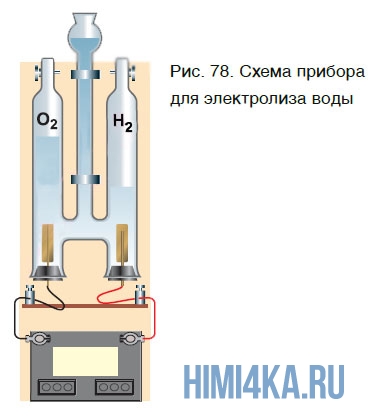
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e16f3051e506b3f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 45г воды?
Химия | 5 — 9 классы
Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 45г воды.
(Объясните как вычислить тут массу и откуда мы что берём).
2H2O (электролиз) → 2H2 + O2
Можно просто воспользоваться формулой :
Хоть это и лишнее действие, но найдем кол — во вещества h2o
nH2O = 45 / 18 = 2, 5 МОЛЬ
По уравнению реакции n(O2) = 2, 5 / 2 = 1, 25 МОЛЬ
Значит m(O2) = 1, 25 * 32 = 40 г
Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 90г воды?
Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 90г воды.
Вычислите массу водорода который вступит в реакцию с кислородом если образовалось 200 г Воды?
Вычислите массу водорода который вступит в реакцию с кислородом если образовалось 200 г Воды.
Вычислить массу воды, полученной при взаимодействии водорода с 16 г кислорода?
Вычислить массу воды, полученной при взаимодействии водорода с 16 г кислорода.
Вычислить массу кислорода затраченную для получения 1?
Вычислить массу кислорода затраченную для получения 1.
Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 90г воды?
Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 90г воды.
Вычислите массу и количество вещества воды, которую можно получить из 7 моль водорода при взаимодействии кислородом схема реакции(H2 + — — H2O)?
Вычислите массу и количество вещества воды, которую можно получить из 7 моль водорода при взаимодействии кислородом схема реакции(H2 + — — H2O).
Вычислите массу кислорода, которая получится при разложении 3?
Вычислите массу кислорода, которая получится при разложении 3.
По уравнению химических реакций 2H2 + O2 = 2H2O вычислить количество вещества и массу кислорода, затраченное на получение 1?
По уравнению химических реакций 2H2 + O2 = 2H2O вычислить количество вещества и массу кислорода, затраченное на получение 1.
Вычислите массу воды, которую нужно взять для получения 160г кислорода?
Вычислите массу воды, которую нужно взять для получения 160г кислорода.
Схема реакции : H2O — > ; H2 + O2.
Составьте уравнение реакции получения кислорода разложением воды и вычислите массу кислорода, который можно получить из 45 г воды?
Составьте уравнение реакции получения кислорода разложением воды и вычислите массу кислорода, который можно получить из 45 г воды.
Вы находитесь на странице вопроса Составьте уравнение реакции получения кислорода из воды и вычислите массу кислорода, который можно получить из 45г воды? из категории Химия. Уровень сложности вопроса рассчитан на учащихся 5 — 9 классов. На странице можно узнать правильный ответ, сверить его со своим вариантом и обсудить возможные версии с другими пользователями сайта посредством обратной связи. Если ответ вызывает сомнения или покажется вам неполным, для проверки найдите ответы на аналогичные вопросы по теме в этой же категории, или создайте новый вопрос, используя ключевые слова: введите вопрос в поисковую строку, нажав кнопку в верхней части страницы.
Гидроксид меди(основание) азотная кислота (кислоты) оксид фосфора 5 класс оксиды гидроксиды алюминия 3 основание оксид плюмбума (оксид).
То, где есть группа ОН – это основания, или гидрооксиды (меди, алюминия), второе – азотная кислота, третье оксид фосфора, последнее – оксид свинца.
Одна из структурных составляющих стали и чугунаструктурн. Составляющая стали и чугуна.
4H₂S⁺⁶O₄ + P⁻³H₃ = H₃P⁺⁵O₄ + 4H₂O + 4S⁺⁴O₂ S⁺⁶ + 2e = S⁺⁴ 8 4 P⁻³ — 8e = P⁺⁵ 2 1.
Структурная формула во вложении.
1)2Zn + O2 = 2ZnO 2)ZnO + H2SO4 = ZnSO4 + H2O 3) ZnSO4 + 2NaCl = ZnCl2 + Na2SO4 4)ZnCl2 + 2NaOH = Zn(OH)2 + 2NaCl 5)2 NaOH + Zn(OH)2 = Na2ZnO2 + 2H20(Если в растворе — будут другие вещества, а тут именно при сплавлении) Если помог, нажми кнопочку спа..
Во второй реакции написал, что образуется виниловый спирт, не устойчивое соединение, которое потом переходит в этаналь. Но можешь его не писать.
Решение : (А) Al / Al2(SO4)3 / / Fe2(SO4)3 / Fe (К) Уравнение электродных процессов : Al( — ) : Al — 3e = Al(3 + ) Fe( + ) : Fe(3 + ) + 3e = Fe Уравнение реакции : 2Al + Fe2(SO4)3 — — — >Al2(SO4)3 + 2Fe.
200 : 100 = 2 г — это 1% 2×12 = 24 г — уксусной кислоты 200 — 24 = 176 г — воды.
http://gomolog.ru/reshebniki/9-klass/tetrad-gabrielyan-2020/24/chast-1-zadanie-5.html
http://himia.my-dict.ru/q/1058725_sostavte-uravnenie-reakcii-polucenia-kisloroda-iz/