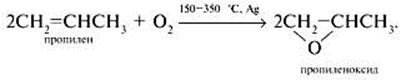1.дано вещество 2 целил пентен2 запишите формулы 4 изомеров и 2
1.дано вещество 2 целил пентен2 запишите формулы 4 изомеров и 2 гомолога
2.запишите уравнение неполное окисление кислорода воздуха пропена
4.полное окисление бутена
5.присоединение НВr пентену 2 .назовите полувшиеся вещества
пожалуйста помогите
- Курлатник Альбина
- Химия 2019-08-10 07:29:33 0 1
2-метилпентен-2
CH3-C=CH-CH2-CH3
I
CH3
Изомеры:
CH3-CH=CH-CH2-CH3
I
CH3 3-метилпентен-2
CH3-CH=CH2-CH-CH3
I
CH3 4-метилпентен-2
СH2=C-CH2-CH2-CH3
I
CH3 2-метилпентен-1
CH3-CH2-CH=CH-CH3
I
CH3 2-метилпентен-2
гомологи
CH3-C=CH-CH2-СH2-CH3
I
CH3 2-метилгексен-2
CH3-C=CH-CH3
I
CH3 2-метилбутен-2
2. С3H6+6O2-gt;3CO2+6H2O
3. nCH3-CH=CH-CH2-CH2-CH3-gt;(-CH2-CH2-CH2-CH-CH2-CH2-)n
4. C4H8+8O2-gt;4CO2+8H2O
5. СH3-CH=CH-CH2-CH3+HBr-gt;CH3-CH2-CHBr-CH2-CH3 3-бромпентан
Окисление кислородом воздуха в пропиленоксид
При нагревании в присутствии серебряных катализаторов:
Получение
| В лаборатории |
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование пропина в присутствии катализатора (Pd):
3. Дегидратация изопропилового спирта (отщепление воды). В качестве катализатора используют кислоты (серную или фосфорную) или Аl2O3:
4. Отщепление двух атомов галогена от дигалогеноалканов, содержащих галогены при соседних атомах С. Реакция протекает под действием металлов (Zn и др.):
В промышленности
Обычно пропилен выделяют из газов нефтепереработки (при крекинге сырой нефти в кипящем слое (процесс фирмы BASF), пиролизе бензиновых фракций) или попутных газов, а также из газов коксования угля. Существует несколько видов пиролиза пропилена: пиролиз в трубчатых печах, пиролиз в реакторе с кварцевым теплоносителем (процесс фирмы Phillips Petroleum Co.), пиролиз в реакторе с коксовым теплоносителем (процесс фирмы Farbewerke Hoechst), пиролиз в реакторе с песком в качестве теплоносителя (процесс фирмы Lurgi), пиролиз в трубчатой печи (процесс фирмы Kellogg), процесс Лавровского — Бродского, автотермический пиролиз по Бартоломе. В промышленности пропилен получают также дегидрированием алканов в присутствии катализатора (Сr2О3, Аl2О3).
Промышленным способом получения пропилена наряду с крекингом служит дегидратация пропанола над оксидом алюминия:
Применение
Для производства оксида пропилена, получения изопропилового спирта и ацетона, для синтеза альдегидов, для получения акриловой кислоты и акрилонитрила, полипропилена, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Янтарная кислота(Бурштиновая кислота)
| Химическая формула | НООС-СН2-СН2-СООН |
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота) — двухосновная предельная карбоновая кислота. Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Впервые получена в XVII веке перегонкой янтаря. Соли и эфиры янтарной кислоты называются сукцинатами (лат. succinum — янтарь).
Биохимическая роль
Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши) [2] .
Применение
Янтарную кислоту используют для получения пластмасс, смол, лекарственных препаратов (в частности, хинолитина), для синтетических целей, а также в аналитической химии.
В пищевой промышленности используется в качестве пищевой добавки E363.
В медицине янтарная кислота применяется, в частности, как одно из средств для борьбы с похмельным синдромом [источник?] .
Химические свойства.
Янтарная кислота содержится в небольшом кол-ве в буром угле, прир. смолах, в янтаре (отсюда название). Найдена во мн. растениях.
Конденсация янтарной кислоты или ее эфиров с кетонами и альдегидами в присут. оснований приводит к алкилиденянтарным к-там (см. Штоббе конденсация); при взаимод. с аммиаком и аминами образуются сукцинимид и его N-замещенные производные; с ароматич. соед. в условиях р-ции Фриделя-Крафтса -4-арил-4-кетомасляная к-та (р-ция сукциноилирования). При окислении янтарной кислоты Н2О2 в зависимости от условий образуются пероксиянтарная (СН2СОООН)2, оксоянтарная или малоновая к-ты либо смесь ацетальдегида, малоновой и малеиновой к-т, при окислении КМnО4 — щавелевая к-та или смесь малоновой и винной к-т, при окислении NaClO4 — 3-гидроксипропионовая к-та, Каталитич. восстановление янтарной кислоты в зависимости от катализатора и условий р-ции приводит к 1,4-бутандиолу, 

При 235 °С янтарная кислота отщепляет воду, давая янтарный ангидрид, при фотохим. распаде mpem-бутилпероксиэфиров — этилен.
Я нтарная кислота вступает в р-ции замещения по активным метиленовым группам. Нагревание с бромом в закрытом сосуде при 100 °С дает с количеств. выходом 2,3-дибромянтарную к-ту.
Янтарную кислоту получают в качестве побочного продукта при произ-ве адипиновой к-ты, а также выделяют из смеси к-т, образующихся при окисленииуглеводородов С4 — С10. Янтарная кислота может быть получена окислением фурфурола пероксидом водорода, гидрированием малеинового ангидрида с последующей гидратацией. Известен пром. способ выделения янтарной кислоты из отходов янтаря.
Соли янтарной кислоты образуются при окислении 1,4-бутандиола р-ром Na2O2 или 
Применяют янтарную кислоту для получения алкидных смол, сукцинатов, фотоматериалов, красителей, лек. в-в. Эфиры янтарной кислоты используют в пищ. и парфюм. пром-сти. Так, диэтилсукцинат -ароматизатор для пищ. продуктов, компонент парфюм. композиций (запах цветов); обладает также св-вамипластификатора. Моно- и диамиды янтарной кислоты с ароматич. и гетероциклич. аминами применяют в произ-ве нек-рых красителей и инсектицидов.
Для янтарной кислоты ПДК в воде водоемов 0,01 мг/л.
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 21, N. Y., 1983, p. 848-6
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. источники: http://allrefrs.ru/1-8479.html http://acetyl.ru/o/a31b2b.php |