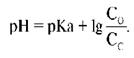Белковая буферная система.
Белковая буферная система представляет собой совокупность альбуминов и глобулинов — белков, составляющих основную часть плазмы крови (
Изоэлектрические точки этих белков лежат в интервале значений рН = 4,9-6,3, т. е., в слабокислой среде. Поэтому в физиологических условиях (при рН = 7,4) белки находятся преимущественно в формах «белок-основание» и соль «белка-основания».
Соответствующее кислотно-основное равновесие:
смещено в сторону преобладания формы «белок-основание».
Буферная емкость, определяемая белками плазмы, зависит от концентрации белков, их вторичной и третичной структуры и числа свободных протонакцепторных групп. Эта система может нейтрали-зовать как кислые, так и основные продукты. Однако вследствие преобладания формы «белок-основание», ее буферная емкость значи-тельно выше по кислоте и составляет: для альбуминов 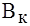
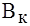
4. Аминокислотная буферная система.
Буферная емкость свободных аминокислот плазмы крови незначительна как по кислоте, так и по щелочи. Это связано с тем, что почти все аминокислоты имеют значения 

Таким образом, мощность буферных систем плазмы крови уменьшается в ряду:
гидрокарбонатная > белковая > фосфатная > аминокислотная
Эритроциты
Во внутренней среде эритроцитов норме соответствует рН = 7,25. Здесь также действуют гидрокарбонатная и фосфатная буферные системы. Однако их мощность отличается от таковой в плазме крови. Кроме того, в эритроцитах большую роль играет белковая система гемоглобин-оксигемоглобин, на долю которой приходится около 75% всей буферной емкости крови.
Гемоглобин является слабой кислотой ( 
При физиологическом значении рН = 7,25 этот описывается уравнением Гендерсона-Гассельбаха:

из которого видно, что:

Таким образом, при рН = 7,25 кислота HHb диссоциирована только на 10% и концентрация солевой формы гемоглобина (Hb — ) значительно меньше, чем концентрация кислоты (HHb).
Система HHb/Hb — может активно нейтрализовать кислые и основные продукты метаболизма, однако обладает более высокой емкостью по щелочи, чем по кислоте.
В легких гемоглобин реагирует с кислородом. При этом образуется оксигемоглобин HHbО2:
который переносится артериальной кровью в капиллярные сосуды, откуда кислород попадает в ткани.
Оксигемоглобин — слабая кислота ( 

соответствует уравнение Гендерсона-Гассельбаха:

Отсюда можно заключить, что С(HbО2 — )/С(HHbО2) = 2:1 и доля продиссоциировавших молекул HHbО2 составляет примерно 65%.
При добавлении кислот нейтрализовать ионы H + в первую очередь будут анионы гемоглобина Hb — :
так как они имеют большее сродство к протону, чем ионы HbO2 — .
При действии оснований в первую очередь будет реагировать более сильная кислота оксигемоглобин HHbO2:
однако и кислота гемоглобин также будет участвовать в нейтрализации поступающих в кровь ионов OH — :
HHb + OH — ⇄ Hb — + H2O.
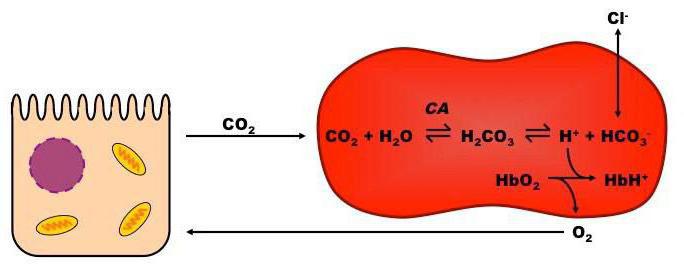
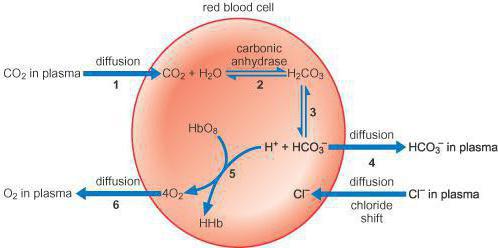
Система гемоглобин-оксигемоглобин играет важную роль как в процессе дыхания (транспортная функция по переносу кислорода к тканям и органам и удалению из них метаболического СО2), так и в поддержании постоянства рН внутри эритроцитов, а в результате и в крови в целом.
В организме человека все буферные системы взаимосвязаны. Так, в эритроцитах гемоглобин-оксигемоглобиновая буферная система тесно связана с гидрокарбонатной буферной системой. Поскольку внутри эритроцитов рН равен 7,25, то соотношение концентраций соли (НСО3 — ) и кислоты Н2СО3 здесь несколько меньше, чем в плазме крови. Действительно, из уравнения Гендерсона-Гассельбаха следует, что в эритроцитах C(НСО3 — )/С(Н2СО3) = 14:1. Тем не менее, несмотря на то, что буферная емкость этой системы по кислоте внутри эритроцитов несколько меньше, чем в плазме, она эффективно поддерживает постоянство рН.
Фосфатная буферная система играет в клетках крови гораздо более важную роль, чем в плазме крови. Прежде всего это связано с тем, что в эритроцитах содержится большое количество неорганичес-ких фосфатов, главным образом, KH2PO4 и K2HPO4. Кроме того, большую роль в поддержании постоянства рН имеют эфиры фосфорных кислот — главным образом, фосфолипиды, составляющие основу мембран эритроцитов.
Фосфолипиды являются относительно слабыми кислотами. Значения 
В случаях, когда буферная и выделительная защита организма исчерпывает свои возможности и развивается тяжелая форма ацидоза (алкалоза), прибегают к медикаментозному подавлению этих наруше-ний. Так, при газовой форме ацидоза внутривенно вводят препараты основного характера, представляющие собой соли слабых кислот: 4%-й раствор NaHCO3, раствор натриевой соли лимонной кислоты — цитрат натрия (Na3Cit) и др., которые нейтрализуют избыточную кислотность, связывая ионы H + в слабые кислоты:
H + + HCO3 — 

Ликвидацию метаболической формы ацидоза также проводят пу-тем введения солей слабых кислот и других препаратов, обладающих свойством проходить через фосфолипидные мембраны.
При алкалозе вводят растворы слабых кислот, например, 4%-й раствор аскорбиновой кислоты.
Однако перечисленные методы медикаментозного вмешательства не имеют, строго говоря, лечебного эффекта: они позволяют лишь «выиграть время» для более детального установления причин возник-новения отклонений и назначения курса лечения или профилактики.
Буферная система: классификация, пример и механизм действия
Огромную роль для нормального функционирования человеческого организма играет кислотно-основное равновесие. Циркулирующая в организме кровь представляет собой смесь живых клеток, которые находятся в жидкой среде обитания. Первой чертой охраны, что контролирует уровень pH в крови, выступает буферная система . Это физиологический механизм, который обеспечивает сохранение параметров кислотно-основного баланса, препятствуя перепадам pH. Что он собой представляет и какие имеет разновидности, узнаем ниже.
Описание
Буферная система — это уникальный механизм. В организме человека существует их несколько, и все они состоят из плазмы и клеток крови. Буферы представляют собою основания (белки и неорганические соединения), которые связывают или отдают Н+ и ОН-, уничтожая сдвиг pH в течение тридцати секунд. Способность буфера поддерживать кислотно-основный баланс зависит от количества элементов, из которых он слагается.
Виды буферов крови
Кровь, которая постоянно движется, представляет собой живые клетки, которые существуют в жидкой среде. pH в норме составляет 7,37-7,44. Связка же ионов происходит определенным буфером, классификация буферных систем приведена ниже. Сам же он состоит из плазмы и кровяных клеток и может быть фосфатным, белковым, бикарбонатным или гемоглобиновым. Все эти системы имеют достаточно простой механизм действия. Их деятельность нацелена на урегулирование уровня ионов в крови.
Особенности буфера гемоглобинового
Гемоглобиновая буферная система является самой мощной из всех, она представляет собой щелочь в капиллярах тканей и кислоту в таком внутреннем органе, как легкие. На ее долю приходится около семидесяти пяти процентов всей буферной емкости. Этот механизм участвует во множестве процессах, что происходят в крови человека, и имеет в своем составе глобин. При переходе гемоглобинового буфера в другую форму (оксигемоглобин), наблюдается изменение этой формы, изменяются и кислотные свойства действующего вещества.
Качество восстановленного гемоглобина меньшее, чем у угольной кислоты, но становится намного лучше, когда он окисляется. Когда приобретается кислотность pH, гемоглобин соединяет ионы водорода, получается так, что он уже восстановленный. Когда происходит очищение углекислого газа в легких, pH получается щелочным. В это время гемоглобин, который окислился, выступает донором протонов, при помощи чего происходит уравновешивание кислотно-основного баланса. Так, буфер, что состоит из оксигемоглобина и его калиевой соли, способствует выделению из организма углекислоты.
Эта буферная система выполняет немаловажную роль в дыхательном процессе, так как совершает транспортную функцию по переносу к тканям и внутренним органам кислорода и удалению из них углекислоты. Кислотно-основное равновесие внутри эритроцитов при этом придерживается на постоянном уровне, следовательно, в крови также.
Таким образом, когда кровь насыщается кислородом, гемоглобин превращается в сильную кислоту, а когда кислород он отдает, то превращается в достаточно слабую органическую кислоту. Системы оксигемоглобина и гемоглобина — взаимопревращающиеся, они существуют как одно целое.
Особенности бикарбонатного буфера
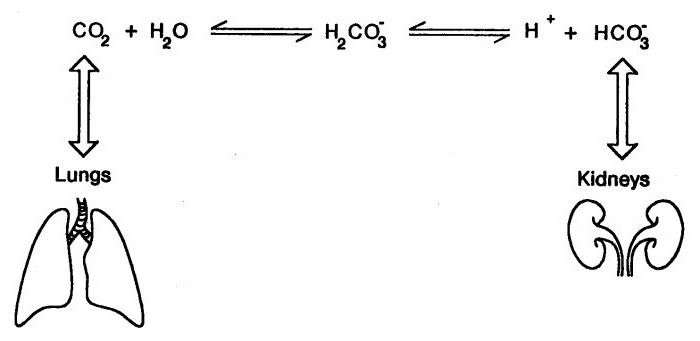
Бикарбонатная буферная система выступает также мощной, но и самой управляемой в организме. На ее долю приходится около десяти процентов всей буферной емкости. Она имеет универсальные свойства, которые обеспечивают ее двухстороннюю эффективность. В состав этого буфера входит сопряженная кислотно-щелочная пара, что состоит из таких молекул, как угольная кислота (источник протона) и бикарбонат аниона (акцептор протона).
Так, бикарбонатная буферная система способствует протеканию систематического процесса, где в кровь попадает мощная кислота. Этот механизм связывает кислоту с бикарбонатом анионов, образуя кислоту угольную и ее соль. При попадании щелочи в кровь буфер связывается с угольной кислотой, образуя бикарбонатную соль. Так как гидрокарбоната натрия в крови человека больше, чем угольной кислоты, данная буферная емкость будет иметь высокую кислотность. Другими словами, гидрокарбонатная буферная система (бикарбонатная) очень хорошо проводит компенсацию веществ, которые повышают кислотность крови. К ним относится и молочная кислота, концентрация которой увеличивается при интенсивных физических нагрузках, а данный буфер очень быстро реагирует на изменения кислотно-основного баланса в крови.
Особенности фосфатного буфера
Фосфатная буферная система человека занимает близко двух процентов всей буферной емкости, что связано с содержанием в крови фосфатов. Этот механизм поддерживает показатель pH в моче и жидкости, что находится внутри клеток. Буфер состоит из неорганических фосфатов: одноосновного (выполняет роль кислоты) и двухосновного (выполняет роль щелочи). При нормальном показателе pH соотношение кислоты и основания равняется 1:4. При увеличении количества ионов водорода фосфатная буферная система связывается с ними, образуя кислоту. Этот механизм больше кислотный, чем щелочной, поэтому он отлично нейтрализует поступающие в кровь человека кислые метаболиты, например, молочную кислоту.
Особенности белкового буфера
Белковый буфер играет не такую особую роль в стабилизации кислотно-щелочного баланса, по сравнению с другими системами. На его долю приходится около семи процентов всей буферной емкости. Белки состоят из молекул, которые объединяются в кислотно-щелочные соединения. В кислой среде они выступают щелочами, которые связывают кислоты, в щелочной среде все происходит наоборот.
Это приводит к тому, что образуется белковая буферная система , которая достаточно эффективна при значении pH от 7,2 до 7,4. Большая доля белков представлена альбуминами и глобулинами. Так как белковый заряд нулевой, то при нормальном показателе pH он находится в виде щелочи и соли. Эта буферная емкость зависит от количества белков, их структуры и свободных протонов. Данный буфер может нейтрализовать и кислые, и щелочные продукты. Но емкость она имеет больше кислотную, чем щелочную.
Особенности эритроцитов
В норме эритроциты имеют постоянный показатель pH – 7,25. Здесь оказывают действие гидрокарбонатный и фосфатный буферы. Но по мощности они отличаются от тех, что находятся в крови. В эритроцитах белковый буфер играет особую роль в обеспечении органов и тканей кислородом, а также удалению из них углекислоты. Кроме этого, он поддерживает постоянное значение внутри эритроцитов pH. Белковый буфер в эритроцитах тесно связан с гидрокарбонатной системой, так как соотношение кислоты и соли здесь меньшее, чем в крови.
Пример буферной системы
Растворы сильных кислот и щелочей, которые обладаю слабыми реакциями, имеют непостоянный показатель pH. Но смесь кислоты уксусной с ее солью сохраняет имеет стабильное значение. Даже если к ним добавить кислоту или щелочь, кислотно-основное равновесие не изменится. В качестве примера можно рассмотреть ацетатный буфер, который состоит из кислоты СН3СООН и ее соли СН3СОО. Если добавить сильную кислоту, то основание соли свяжет ионы Н+ и превратится в кислоту уксусную. Снижение уровня анионов соли уравновешивается увеличением молекул кислоты. В результате этого наблюдается незначительное изменение в соотношении кислоты и ее соли, поэтому pH изменяется совсем незаметно.
Механизм действия буферных систем
При поступлении в кровь кислых или щелочных продуктов буфер обеспечивает постоянное значение pH до тех пор, пока поступившие продукты не выведутся или не используются в процессах метаболизма. В крови человека представлены четыре буфера, каждый из которых состоит из двух частей: кислоты и ее соли, а также сильной щелочи.
Эффект буфера обуславливается тем, что он связывает и нейтрализует ионы, которые поступают соответствующим ему составом. Поскольку в природе организм больше всего сталкивается с недоокисленными продуктами обмена, свойства буфер имеет антикислотные больше, чем антищелочные.
Каждая буферная система имеет свой принцип работы. При снижении уровня pH ниже отметки 7,0 начинается их активная деятельность. Они начинают связывать излишки свободных ионов водорода, образуя комплексы, которые перемещают кислород. Он, в свою очередь, перемещается к системе пищеварения, легким, коже, почкам и так далее. Такая транспортировка кислых и щелочных продуктов способствует их разгрузке и выведению.
В организме человека только четыре буферные системы играют важные роли в сохранении кислотно-основного равновесия, но существуют и другие буферы, например, ацетатная буферная система, которая имеет слабую кислоту (донор) и ее соль (акцептор). Способность этих механизмов противостоять изменениям pH при попадании кислоты или соли в кровь является ограниченной. Они поддерживают кислотно-щелочное равновесие только в том случае, когда сильная кислота или щелочь поступают в определенном количестве. Если оно будет превышено, pH резко изменится, буферная система прекратит свое действие.
Эффективность буферов
Буферы крови и эритроцитов имеют различную эффективность. У последних она выше, так как здесь присутствует гемоглобиновый буфер. Уменьшение количества ионов происходит по направлению от клетки до межклеточной среды, а затем до крови. Это говорит о том, что самая большая буферная емкость у крови, а меньшую имеет внутриклеточная среда.
При метаболизме в клетках появляются кислоты, которые проходят в межклеточную жидкость. Это происходит тем легче, чем их больше появляется в клетках, поскольку переизбыток ионов водорода увеличивает проницаемость мембраны клетки. Нам уже известна классификация буферных систем . В эритроцитах они имеют более эффективные свойства, так как здесь еще играют роль коллагеновые волокна, которые реагируют набуханием на накопление кислоты, они ее поглощают и освобождают от ионов водорода эритроциты. Такая его способность обуславливается свойством абсорбции.
Взаимодействие буферов в организме
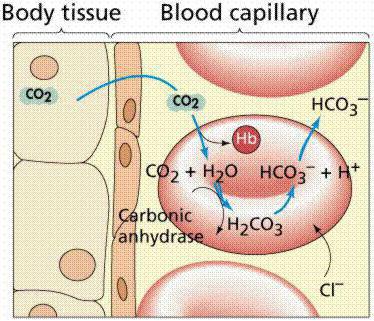
Все механизмы, которые находятся в организме, взаимосвязаны между собой. Буферы крови состоят из нескольких систем, вклад которых в поддержание кислотно-щелочного баланса различный. При попадании крови в легкие она получает кислород путем его связывания в эритроцитах гемоглобином, образуя оксигемоглобин (кислоту), что поддерживает уровень pH. При содействии карбоангидразы происходит параллельное очищение крови легких от углекислоты, которая в эритроцитах представлена в виде слабой двухосновной угольной кислотой и карбаминогемоглобином, а в крови – углекислотой и водой.
При уменьшении в эритроцитах количества слабой двухосновной угольной кислоты происходит проникновение ее из крови в эритроцит, и очищение крови от углекислоты. Таким образом, из клеток в кровь постоянно проходит слабая двухосновная угольная кислота, а из крови в эритроциты для соблюдения нейтральности поступают неактивные анионы хлорида. В результате этого в красных клетках крови среда более кислотная, чем в плазме. Все системы буферов обосновываются отношением донор-акцептор протона (4:20), что связано с особенностями метаболизма организма человека, который образует большее число кислотных продуктов, чем щелочных. Очень важным здесь является показатель кислотных буферных емкостей.
Обменные процессы в тканях
Кислотно-основной баланс поддерживается буферами и метаболическими превращениями в тканях организма. Этому помогают биохимические и физико-химические процессы. Они способствуют потере кислотно-щелочных свойств продуктов обмена веществ, их связыванию, образованию новых соединений, которые быстро выводятся из организма. Например, большое количество молочной кислоты выводится в гликоген, органические кислоты нейтрализуются солями натрия. Сильные кислоты и щелочи растворяются в липидах, а органические кислоты подвергаются окислению, образуя угольную кислоту.
Таким образом, буферная система — это первый помощник при нормализации кислотно-щелочного баланса в организме человека. Стабильность pH нужна для нормальной работы биологических молекул и структур, органов и тканей. При нормальных условиях буферные процессы поддерживают равновесие между появлением и удалением ионов водорода и углекислого газа, что способствует обеспечению в крови постоянного уровня pH.
Если происходит сбой в работе буферных систем, то у человека появляются такие патологии, как алкалоз или ацидоз. Все буферные системы взаимосвязаны и направлены на поддержание стабильного кислотно-основного равновесия. В организме человека постоянно образуется большое число кислых продуктов, которое эквивалентно тридцати литрам сильной кислоты.
Постоянство реакций внутри организма обеспечивают мощные буферы: фосфатный, белковый, гемоглобиновый и бикарбонатный. Существуют и другие буферные системы, но эти являются основными и самыми нужными для живого организма. Без их помощи у человека начнут развиваться различные патологии, которые могут привести к коме или летальному исходу.
Буферные системы, их классификация и механизм действия. Буферные растворы. Уравнение Гендерсона-Гассельбаха.
Буферными системами (буферами) называют растворы, обладающие свойством достаточно, стойко, сохранять постоянство — концентрации водородных ионов как при добавлении кислот или щелочей, так и при разведении.
Буферные системы (смеси или растворы) по составу бывают двух основных типов:
а) из слабой кислоты и ее соли, образованной сильным основанием;
б) из слабого основания и его соли, образованной сильной кислотой.
На практике часто применяют следующие буферные смеси: ацетатный буфер CH3COOH + CH3COONa, бикарбонатный буфер H2CO3+NaHCO3, аммиачный буфер NH4OH +NH4Cl, белковый буфер белок кислота + белок соль, фосфатный буфер NaH2PO4 + Na2 HPO4
Фосфатная буферная смесь состоит из двух солей, одна из которых является однометаллической, а вторая — двухметаллической солью фосфорной кислоты.
Рассмотрим механизм буферного действия. При добавлении соляной кислоты к ацетатному буферу происходит взаимодействие с одним из компонентов смеси (СНзСООН); Из уравнения (а), сильная кислота заменяется эквивалентным количеством слабой кислоты (в данном случае НСl заменяется СН3СООН). В соответствии с законом разведения Оствальда повышение концентрации уксусной кислоты понижает степень ее диссоциации, а в результате этого концентрация ионов Н + в буфере увеличивается незначительно. При добавлении к буферному раствору щелочи концентрация водородных ионов и рН изменяется также незначительно. Щелочь при этом будет реагировать с другим компонентом буфера, (СН3СООН) по реакции нейтрализации. В результате этого добавленная щелочь заменяется эквивалентным количеством слабоосновной соли, в меньшей — степени влияющей на реакцию среды. Анионы СНзСОО
, образующиеся при диссоциации этой соли, будут оказывать некоторое Угнетающее действие на диссоциацию уксусной кислоты.
Буферные растворы в зависимости от своего состава делятся на 2 основных типа: кислотные и основные.
Примером кислотного буфера может служить ацетатный буферный раствор, содержащий смесь уксусной кислоты и ацетата натрия (СНзСООН + СНзСООNа). При добавлении к такому раствору кислоты она взаимодействует с солью и вытесняет эквивалентное количество слабой кислоты: СНзСООNа + НСl ó СН3СООН + NaСl. В растворе вместо сильной кислоты образуется слабая, и поэтому величина рН уменьшается незначительно. Если к этому буферному раствору добавить щелочь, она нейтрализуется слабой кислотой, и в растворе образуется эквивалентное количество соли: СНзСООН + NaОН ó СНзСООNа + Н2О. В результате рН почти не увеличивается. Для расчета рН в буферном растворе на примере ацетатного буфера рассмотрим процессы, в нем протекающие, и их влияние друг на друга. Ацетат натрия практически полностью диссоциирует на ионы, ацетат-ион подвергается гидролизу, как ион слабой кислоты: СНзСООNа -> Na + + СН3СОО
СНзСОО — + НОН ó СНзСООН + ОН — . Уксусная кислота, также входящая в буфер, диссоциирует лишь в незначительной степени: СНзСООН ó СН3СОО+H — Слабая диссоциация СНзСООН еще более подавляется в при-сутствии СНзСООNа, поэтому концентрацию недиссоциированной уксусной кислоты принимаем практически равной ее начальной концентрации:[СНзСООН] = сr. C другой стороны, гидролиз соли также подавлен наличием в растворе кислоты. Поэтому можно считать, что концентрация ацетат-ионов в буферной смеси практически равна исходной концентрации соли без учета концентрации ацетат-ионов, образующихся в результате диссоциации кислоты: [СНзСОО] = сс. Это уравнение называют уравнением буферного раствора (уравнением Гендерсона Гассельбаха). Его анализ для буферного раствора, образованного слабой кислотой и ее солью, показывает, что концентрация водородных ионов в буферном растворе определяется константой диссоциации слабой кислоты и соотношением концентраций кислоты и соли. Уравнение Гендерсона-Хассельбаха для буферных систем основного типа:
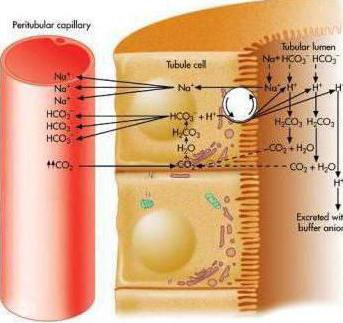
31.Емкость буферных растворов и факторы, определяющие её. Буферные системы крови. Водородкарбонатный буфер. Фосфатный буфер.
Буферной емкостью (В) называется количество сильной кислоты или сильного основания, которое нужно прибавить к одному литру буферного раствора, чтобы изменить его рН на единицу. Она выражается в моль/л или чаще в ммоль/л и определяется по формуле: В = (c V) / д pH Vб , где В — буферная емкость; с — концентрация сильной кислоты или основания (моль/л); V — объем добавленного сильного электролита (л); Vб — объем буферного раствора (л); д рН — изменение рН.
Способность растворов поддерживать постоянное значение pH небезгранична. Буферные смеси можно различить по силе оказываемого ими сопротивления по отношению к действию кислот и оснований, вводимых в буферный раствор.
Количество кислоты или щелочи, которое нужно добавить к 1 л буферного раствора, чтобы значение его pH изменилось на единицу, называют буферной емкостью.
Таким образом, буферная емкость является количественной мерой буферного действия раствора. Буферный раствор имеет максимальную буферную емкость при pH = pK кислоты или основания, образующей смесь при соотношении ее компонентов, равном единице. Чем выше исходная концентрация буферной смеси, тем выше ее буферная емкость. Буферная емкость зависит от состава буферного раствора, концентрации и соотношения компонентов.
Нужно уметь правильно выбрать буферную систему. Выбор определяется необходимым интервалом pH. Зона буферного действия определяется силовым показателем кислоты (основания) ±1 ед.
При выборе буферной смеси необходимо учитывать химическую природу ее компонентов, так как вещества раствора, к которым добав-
ляется буферная система, могут образовывать нерастворимые соединения, взаимодействовать с компонентами буферной системы.
http://fb.ru/article/336304/bufernaya-sistema-klassifikatsiya-primer-i-mehanizm-deystviya
http://helpiks.org/6-49353.html