Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6dfc828f1d4516bb • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Как получают кислород в лаборатории и в промышленности? Напишите уравнения соответствующих реакций. Обсудите с соседом по парте, чем различаются эти способы.
В лаборатории кислород обычно получают:
А) термическим разложением (нагреванием) перманганата калия
2KMnO4 = K2MnO4 + MnO2 + O2↑
Б) воздействием оксида марганца (IV) – выступает в роли катализатора – на пероксид водорода
2H2O2 = 2H2O + O2↑
Реже используют разложение бертолетовой соли под воздействием
оксида марганца (IV) в качестве катализатора
2KClO3 = 2KCl + 3O2↑
В промышленности кислород получают с из сжиженного воздуха: температура кипения жидкого азота ниже (-196° С), чем кислорода (-183° С), поэтому азот испаряется (улетучивается) первым.
Разница между лабораторными и промышленным методом очевидна: в промышленности используют физические методы разделения смеси (перегонку), а в лаборатории кислород получают химическими методами (разложения).
Запишите уравнения реакций получения кислорода в лаборатории каким
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Назовите аллотропные модификации кислорода и сравните их свойства.
Для кислорода характерны две аллотропные модификации: кислород O2 и озон O3. Эти простые вещества различаются числом атомов в молекуле.
Сравнение физических свойств.
Кислород ― бесцветный газ, без вкуса и запаха, малорастворим в воде, плотность при н.у. 1,43 г/л.
Озон ― голубой газ с характерным запахом свежести, ядовит, намного лучше растворяется в воде, чем кислород, плотность в 1,5 раза больше, чем у кислорода, то есть 2,1 г/л.
Сравнение химических свойств.
Кислород взаимодействует со многими веществами при нагревании с выделением тепла и света.
Озон значительно более химически активен, чем кислород. Это связано с тем, что молекула озона распадается на атом и молекулу кислорода (O3=O2+O), а атомарный кислород намного активнее молекулярного. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются, каучук становится хрупким, а красители обесцвечиваются.
Задание 2
Какое значение в природе имеет озон и где он применяется? В верхних слоях атмосферы под влиянием ультрафиолетового излучения Солнца кислород превращается в озон: 3О2 = 2О3. Аллотропное видоизменение кислорода ― озон ― обеспечивает жизнь на Земле. Больше всего его на высоте 15-25 км, где он образует озоновый слой, который поглощает опасные для живых организмов излучения Солнца и защищает Землю от резкого переохлаждения. Без озонового слоя средняя температура на Земле была бы на 30°С ниже.
Озон применяется при обеззараживании (гибнут болезнетворные микроорганизмы) питьевой воды, воды в бассейнах, сточных вод, для отбеливания тканей, удаления запаха (дезодорирования) продуктов питания, дезинфекции воздуха в помещениях.
Задание 3
Запишите уравнения реакций получения кислорода в лаборатории.
Кислород в лаборатории получают из перманганата калия, пероксида водорода, бертоллетовой соли:
1) KMnO4 = K2MnO4 + MnO2 + O2↑ при нагревании
2) 2H2O2 MnO₂ = 2H2O + O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO2
3) 2KClO3 = 2KCl + 3O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO 2
Каким образом можно:
а) собрать кислород в сосуд;
Кислород можно собрать методом вытеснения воздуха, держа пробирку вниз дном (кислород тяжелее воздуха), или методом вытеснения воды (кислород плохо растворяется в воде) .
б) доказать наличие кислорода в сосуде?
Можно с помощью тлеющей лучины, которая ярко вспыхнет в сосуде, где находится кислород.
Задание 4
Как кислород получают в промышленности?
Двумя способами:
1-й способ. Кислород добывают фракционной перегонкой (или ректификацией) жидкого воздуха в специальных аппаратах, называемых ректификационными колоннами. 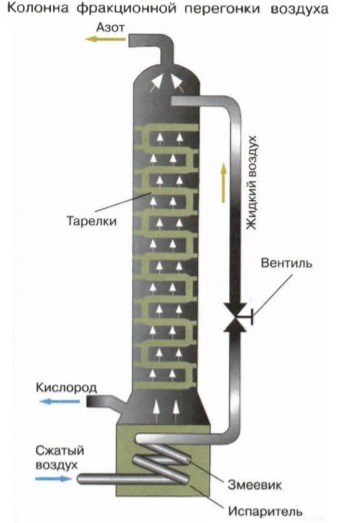
С помощью специальных компрессоров воздух сжимают и охлаждают, при этом все его компоненты переходят в жидкое агрегатное состояние. Жидкий воздух подают в верхнюю часть ректификационной колонны, представляющую собой высокий цилиндр, разделённый множеством поперечных перегородок — тарелок. Стекая по тарелкам, жидкость постепенно нагревается, при этом из неё начинает испаряться самый легкокипящий компонент — азот (tкип.-196°С), который поднимается в верхнюю часть колонны, а стекающая в нижний резервуар жидкость представляет собой жидкий кислород (tкип.-183°С ).
2-й способ. Часто в промышленности кислород добывают реакцией разложения воды — электролизом (под действием электрического тока вода разлагается на два простые вещества — кислород и водород) :
2H2O = 2H2↑ + O2↑ (электрический ток)
Задание 5
Назовите области применения кислорода. В металлургии и химической промышленности, для газовой сварки и резки металлов, в качестве окислителя ракетного топлива космических кораблей, для жизнеобеспечения на подводных лодках, орбитальных станциях и в авиационной технике. В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Задание 6
Запишите уравнения реакций
А) 2SO2 + O2 = 2SO3
Б) 2Li2S + 3O2 = 2SO2 + 2Li2O
В) 2NaNO3 = 2NaNO2 + O2 ↑
Г) 2C2H2 + 5O2 = 4CO2 + 2H2O
Задание 7
Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути (II). Запишите уравнение этой реакции.
Нагревая с помощью линзы красный порошок оксида ртути, Джозеф Присли получил кислород.
2HgO = 2Hg + O2↑
К какому типу реакций по тепловому эффекту она относится? Эндотермическая реакция.
Задание 8
Подготовьте сообщение по одной из тем:
а) «Происхождение и изменение состава земной атмосферы»;
Ранняя вулканическая атмосфера Земли состояла из метана и кислорода, при этом состав постоянно менялся, поскольку метан окислялся кислородом до углекислого газа, аммиака и воды. Со временем большая часть метана израсходовалась на окисление, сильно сократив концентрацию кислорода, температура атмосферы стала снижаться, вследствие чего пары воды стали конденсироваться, образуя океаны и водоемы, а углекислый газ, растворяясь в водоемах, откладывался в виде карбонатов в горных породах и минералах. Аммиак под действием кислорода и бактерий денитрифицировался с высвобождением азота. Современная атмосфера состоит в основном из азота (78%), кислорода (21%) и смеси газов (1%).
б) «Из истории открытия кислорода»;
в) «Значение кислорода в жизни».
Задание 9
Присутствие кислорода в атмосфере Земли делает её пригодной для жизни. Однако известно и негативное влияние кислорода. Приведите примеры отрицательных явлений, связанных с наличием кислорода в воздухе. Предложите методы борьбы с этими явлениями.
Процессы гниения и разложения (порча) продуктов питания. Метод борьбы: охлаждение или заморозка, использование вакуумной упаковки.
При вдыхании воздуха, содержащего более 60% кислорода, у человека может возникнуть «кислородное отравление» ― гипероксия, от которой чаще всего страдают водолазы или пациенты, использующие кислородные аппараты. Метод борьбы: тщательный контроль технической исправности таких аппаратов, а также строгое соблюдение техники безопасности и инструкции по их применению.
http://himgdz.ru/gdz-rudzitis-8-22-2/
http://gdz.cool/h8_gos_2018/1250-h8_gos_2019___13__.html